Протеини: строителство и имоти. Протекови функции
Сред сложните биополимери във функционална стойност и в количественото съотношение основната роля принадлежи на протеините. В животинската клетка те представляват 40-50% от сухата му маса, в зеленчуци - 20 - 35%. Огромното разнообразие от живи същества до голяма степен се определя от разликите в техните протеини. Само в човешкото тяло има повече от 5 милиона вида. Причината за такова разнообразие от протеини се обяснява с спецификата на тяхната структура. Протеини . \\ t полимери, мономери които са аминокиселини. Той е известен 20 вида аминокиселини, които са част от протеиновите молекули, които те се наричат \u200b\u200bосновни, за да се разграничат и от други аминокиселини, които също присъстват в организмите, но не и част от протеинови молекули. Всички тези аминокиселини в състава на техните молекули имат еднаква структура на атомите.
N-син, където Coxy е карбоксилна група, NH2 -
амино група.
Четвъртата валена въглеродна връзка е заета от така наречената радикална (R). Радикалите на различни видове аминокиселини се различават един от друг чрез химическа структура, електрически заряди, както и в способността за разтваряне във вода. Аминокиселините са амфотерни съединения, т.е. същата аминокиселина може да действа като киселина и ролята на алкали. Киселинни свойства дава на нейната карбоксилна група (кокси) и алкална амино група (NH2). Благодарение на Amphoterity, аминокиселините могат да взаимодействат помежду си и един от тях действа като киселина, а другата в ролята на алкали; Карбоксилна група от една аминокиселина взаимодейства с аминогрупата друга). Съединението от аминокиселини в бъбреците на протеина се извършва за сметка на трайни ковалентни връзки. Този процес може да бъде написан с помощта на такова уравнение:
Полученото съединение от аминокиселини се нарича пептид и ковалентна връзка между тях - пептидна връзка. Всички протеини са полипептиди, т.е. вериги, състоящи се от много десетки и дори стотици аминокиселинни връзки. От 20 вида аминокиселини, можете да конструирате огромно количество протеини, точно както от 20 букви от азбуката могат да бъдат съставени много думи, чийто значение ще зависи от това кои букви са изготвени, в които Вземат се количества и в какъв ред са инсталирани. Свойствата на протеиновата молекула се определят чрез състава на аминокиселини, броя на аминокиселинните връзки, както и реда на следващите им във веригата.
Последователността на аминокиселинните остатъци в протеиновата молекула го определя първичен Структура (фиг. 1-i). Ако считаме, че размерът на едно аминокиселинно ниво е 0.35-0.37 nm, очевидно е, че протеин макромолекулата, която се състои от стотици аминокиселинни остатъци, трябва да има няколко десетки нанометра. В действителност, размерът на протеините е много по-малък, защото в пространството полипептидната верига е напълно или частично усуквана в спиралата, която е втори Структурата на протеина (фиг. 1-II). Аминокиселинните радикали остават извън спиралата навън и между NH групи, разположени на един завой, и се образуват когрупи, разположени върху съседния обрат на спиралите, се образуват водородни връзки. Те са много по-слаби от ковалент, но повтарящи се многократно дават твърд сцепление. Полипептидната спирала, "зашит" с много водородни връзки, е достатъчно твърда конструкция. Полипептидната спирала е подложена на по-нататъшно полагане - той се срива странно, но за всеки протеин определено и постоянно в така наречения глобус (топка), който е tertiary. Структурата на протеиновата молекула (фиг. 1-III).
Трейната протеинова структура се поддържа от облигациите на три вида: йонни, водород и дисулфид, както и хидрофобни взаимодействия. В количествено отношение хидрофобните връзки са най-важни: във водната среда, клетките са хидрофобни радикали, отблъскват се един до друг. Така водната среда изглежда принуждава протеинова молекула да се вземе определена подредена структура, която става биологично активна.
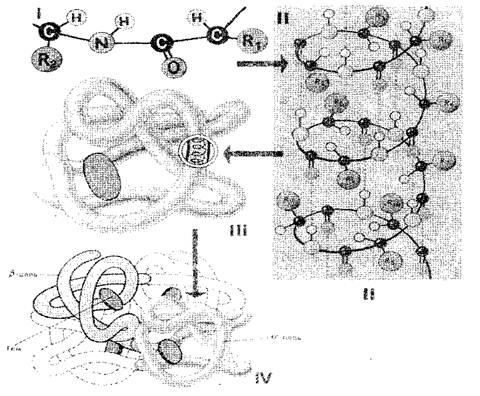
Фиг. 1. Схема на структурата на протеиновите клетки: I, II, III, IV - първична, вторична, третична, кватернерна структура
Протеините, състоящи се от една полипептидна верига, имат само третична структура. Въпреки това, някои протеини са изградени от няколко полипептидни вериги. За тях въвеждат концепцията кутернарна структура (Фиг. 1-IV), който е единична функционална единица, държана както от хидрофобни взаимодействия, така и от водород и йонни връзки. Кватернерната структура е характерна, например за хемоглобин. Неговата молекула се състои от четири отделни полипептидни вериги. Някои вируси, например, тютюневият вирус, има протеинова обвивка, състояща се от много полипептидни вериги, опаковани с високо поръчан начин.
При действието на различни физикохимични фактори (действията на концентрирани киселини и основи, тежки метали, високи температури и др.) Структура и следователно свойствата на протеиновите молекули могат да варират. Процесът на нарушаване на естествената структура на протеини или разгъване на полипептидна верига без прекъсване на пептидните връзки се нарича денатурация Протеин (фиг. 2). Като правило, денатурирането е необратимо, обаче, при първите етапи, подлежащи на спиране на действието на отрицателните фактори, протеинът може да възстанови първоначалната си структура - този процес се нарича rENATURA. катерица. Процесът на унищожаване на първичната протеинова структура е винаги необратим, той се нарича унищожаване на протеини.
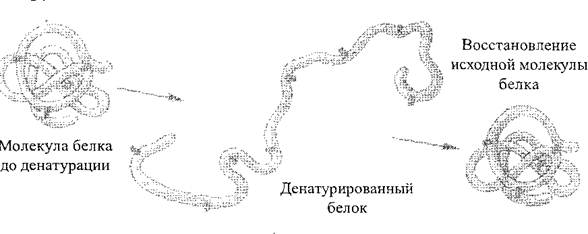
Фиг. 2. Схема на процеса на денатурация на протеини
Физическите и химичните свойства на протеините са много разнообразни: протеините са хидрофилни и хидрофобни, като един от тях лесно променя структурата си в резултат на дори малките ефекти на екологичните фактори, други са устойчиви на тези фактори. Във физически и химични свойства протеините се разделят на прости (протеини) и сложни (протеиди).
Обикновените протеини се състоят изключително от аминокиселинни остатъци, съединението включва и други естествени съединения, такива като остатъчни фосфорни и нуклеинови киселини, въглехидрати, липиди и др.
Биологичните функции на протеините са изключително разнообразни. На първо място, те изпълняват строителство функция. Протеините са неразделна част от клетъчните мембрани, от които такива немблеми на клетки на клетки, като микротубула и микрона, компоненти на клетъчния скелет (цитоскелет) се състоят. От протеини, които имат здравина и еластичност, се състоят от хрущял, сухожилия, лигаменци. От издръжлив и неразтворим протеинов кератин, построен нокти, пера. В допълнение към строителството, протеините също изпълняват защитно Функцията, която лежи, е както за предотвратяване на увреждане на клетките, органите и организма като цяло и в защитата на тялото от паразити и извънземни протеини. В тялото на гръбначни животни се образуват защитни протеини - антитела. Това са специализирани протеини, които се произвеждат от лимфоцити от кръв. Те могат да "разпознаят" и неутрализират бактериите, вирусите, чужденец на тялото на протеините. Фибринният кръвен протеин причинява неговото коагулация, защитавайки тялото от голяма загуба на кръв.
Регулиране Функцията на протеините е способността да се регулира активността на метаболизма с използване на протеинови хормони на природата, както и протеинови ензими. Протеините изпълняват I. сигнал функция. Състои се в способността на отделните сложни протеини, които са част от клетъчната мембрана, "разпознават" специфични химични съединения и реагират на тях: да ги свързват, променят структурата си, предават сигнали за присъствието на тези вещества в други области на мембраната или вътре в клетката. Благодарение на сигналната функция на протеините, клетката може да абсорбира вещества от външната среда.
Мотор Функцията на протеините се крие в способността на някои от тях да се свиват, като по този начин се осигурява възможността клетки, тъкани, тялото като цяло да променят формата си, да се движи. Така, поради такива протеини като актин и миозин, които са част от мускулни клетки, мускулести фибри се съкращава; Турбулинният протеин, от който микротубула и микро, осигурява движението на цилия и вкусове на еукариотни клетки.
Някои протеини могат да бъдат отложени от клетка за резервата, като по този начин се представя боядисване функция.
В ендосперм на семената на много растителни видове (пшеница, царевица, ориз) има протеини, които Герид се храни в първите етапи на неговото развитие. Функцията на тези протеини може да се определи като подхранващо.
Протеините могат да упражняват транспорт Някои вещества в клетката и вътре в тялото. Например, човешкия кръвен протеин и гръбначни животни хемоглобин транспортира кислород от респираторни органи към клетки и въглероден диоксид - в обратна посока.
Енергия Функцията на протеините е, че когато се разделят в клетката, се освобождава енергия. Някои от аминокиселините, които се образуват по време на разделянето, се използват за биосинтеза на нови протеини, а останалите се разделят на крайните продукти на разпадане с освобождаване на енергия (с пълно разцепване 1 g протеини, 17.2 kJ енергия се освобождава ).
Една от основните функции на протеина - ензимен. Ензимите са биологични катализатори или химически реакционни ускорители, преминаващи в жив организъм. Както е известно, скоростта на химични реакции значително зависи от концентрацията на вещества, както и температурата на средата, в която тези реакции продължават. Ако считаме, че животът на клетката (тялото) е комбинация от огромен брой реакции на синтез и гниене, които съставляват метаболизма, огромната роля на протеиновите ензими в процесите на препитанието на организма изобщо нивата стават ясни. Само поради ензими, при относително ниска температура на тялото и ниска концентрация на вещества в клетките и тъканите, химичните реакции поток с достатъчно висока скорост (ензимната реакция тече 100-1000 пъти по-бързо, отколкото в среда без ензими) . Каталитичната активност на протеиновия ензим причинява не цялата молекула, но само неговата малка част, наречена активният център. Пространствената структура на активния център, тъй като ключът към ключалката е подходящ във форма към пространствената структура на катализираното вещество (субстрат), което обяснява специфичността на протеин-ензимите (фиг. 3).
С денатуриране на протеиновата молекула, структурата на активния център е счупена и ензимът губи своята каталитична способност. Така, протеин-ензимната каталаза, която причинява реакцията на разделяне на водороден пероксид (Н202) към кислород и вода, губи своята каталитична активност след излагане на високи температури. Ето защо капка водороден пероксид, нанесена върху парче сурови картофи, съдържащи голямо количество каталаза, "кипи" и на варени картофи - остава непроменено.
Протеини-ензими, Като причиняват преминаването на химически реакции, те сами остават непроменени, те понякога се сравняват с игла, която свързва две парчета плат заедно, докато тя остава непроменена.
Ензимите са разположени по определен начин в клетката и в тялото като цяло. В клетка ензимите често се свързват със своите мембрани или мембрани на отделни органели (митохондрии, пластид и др.). Ефектът върху тялото на наркотиците, хормоните, отровите е, че те могат да стимулират или, напротив, да инжектират един или друг ензимен процес.
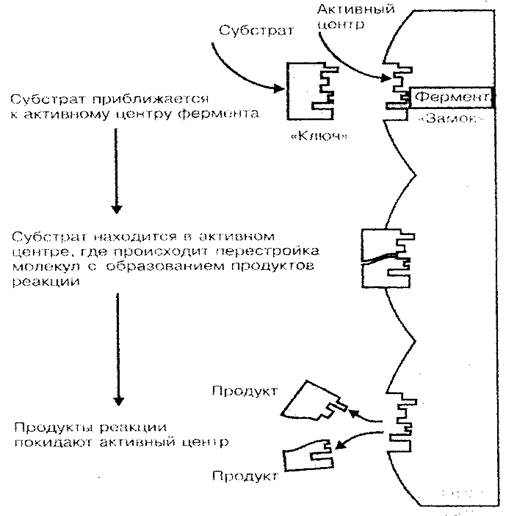
Фиг. 3 ензимна схема за свързване с субстрат
Организмите са способни да регулират биосинтезата на ензимите. Това дава възможност за поддържане на относителната постоянство на техния химичен състав, независимо от непрекъснатите условия на околната среда.
Лабораторна работа номер 1
