Proteiny: Budova a vlastnosti. Protekovské funkce
Mezi složité biopolymery ve funkční hodnotě a v kvantitativním poměru patří hlavní role proteinům. V živočišné buňce představují 40-50% své suché hmoty, v zelenině - 20-- 35%. Obrovská škála živých bytostí je z velké části určeno rozdíly v jejich proteinech. Pouze v lidském těle je více než 5 milionů typů. Důvodem takové řady proteinů je vysvětlen specifikami jejich struktury. Proteiny zastupovat polymery, monomery což jsou aminokyseliny. Je známo 20 typů aminokyselin, které jsou součástí molekul proteinu, které se nazývají bazický, aby se odlišoval od jiných aminokyselin, které jsou také přítomny v organismech, ale ne součástí molekul proteinů. Všechny tyto aminokyseliny ve složení jejich molekul mají stejnou strukturu atomů.
N-syn, kde je coxy karboxylová skupina, NH2 -
aminoskupina.
Čtvrtá zářezová uhlíková vazba je obsazena takzvaným radikálem (R). Radikály různých typů aminokyselin se liší od sebe chemickou strukturou, elektrickými náboji, jakož i ve schopnosti rozpustit ve vodě. Aminokyseliny jsou amfoterní sloučeniny, tj. Stejná aminokyselina může působit jako kyselina a role alkálie. Vlastnosti kyseliny poskytují její karboxylovou skupinu (Coxy) a alkalickou skupinu aminoskupinu (NH2). Díky Amboterity mohou aminokyseliny interagovat mezi sebou, a jeden z nich působí jako kyselina a druhá v úloze alkálie; Karboxylová skupina jednoho aminokyselin interaguje s aminoskupinou jinou). Sloučenina aminokyselin v ledvinách proteinu se provádí na úkor odolných kovalentních vazeb. Tento proces lze napsat pomocí takové rovnice:
Výsledná sloučenina aminokyselin se nazývá peptid a kovalentní vazba mezi nimi - peptidová vazba. Všechny proteiny jsou polypeptidy, tj. Řetězy sestávající z mnoha desítek a dokonce stovek aminokyselinových vazeb. Z 20 typů aminokyselin, můžete postavit obrovské množství proteinů, stejně jako od 20 písmen abecedy lze tvořit spoustu slov, což bude záviset na tom, které dopisy jsou vypracovány, ve které Množství jsou přijata a v jakém pořadí jsou instalovány. Vlastnosti molekuly proteinu jsou určeny kompozicí aminokyselin, počet aminokyselinových vazeb, jakož i řádu jejich následovně v řetězci.
Sekvence aminokyselinových zbytků v molekule proteinu ji určuje hlavní Struktura (obr. 1-i). Pokud se domníváme, že velikost jedné aminokyselinové hladiny je 0,35-0,37 nm, je zřejmé, že protein makromolekuly, která se skládá ze stovek aminokyselinových zbytků, by musely mít několik desítek nanometrů. Ve skutečnosti je velikost proteinů mnohem menší, protože v prostoru je polypeptidový řetězec zcela nebo částečně zkroucený do helixu, což je sekundární Struktura proteinu (obr. 1-II). Aminokyselinové radikály zůstávají mimo spirálu venku, a mezi NH skupinami umístěnými na jednom otáčku, a ko-skupiny umístěné na přilehlém zákroku spirál, jsou vytvořeny vodíkové vazby. Jsou mnohem slabší než kovalentní, ale opakovaně opakovaně dávají pevné uchopení. Polypeptidová spirála, "šitá" s četnými vodíkovými vazbami, je dostatečně pevná struktura. Polypeptidová spirála je podrobena dalšímu pokládání - se zhroutí bizarní, ale pro každý protein je určitě a neustále v tzv globe (míč), který je terciární Struktura molekuly proteinu (obr. 1-III).
Terciární struktura proteinu je podepřena vazbami tří typů: iontový, vodík a disulfid, stejně jako hydrofobní interakce. V kvantitativních termínech jsou nejdůležitější hydrofobní vztahy: Ve vodném médiu jsou buňky hydrofobní radikály, navzájem odpuzují. Zdá se, že vodné médium se zdá, že vynucuje molekulu proteinu pro provedení určité objednané struktury, která se stává biologicky aktivní.
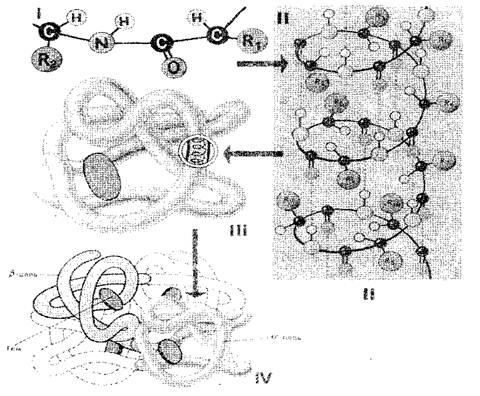
Obr. 1. Schéma struktury proteinových buněk: I, II, III, IV - primární, sekundární, terciární, kvartérní struktura
Proteiny sestávající z jednoho polypeptidového řetězce mají pouze terciární strukturu. Některé proteiny jsou však postaveny z několika polypeptidových řetězců. Pro ně představil koncept kvartérní struktura (Obr. 1-iv), což je jediná funkční jednotka držená jak hydrofobními interakcemi, tak vodíkovými a iontovými vazbami. Kvartérní struktura je charakteristická například pro hemoglobin. Jeho molekula sestává ze čtyř samostatných polypeptidových řetězců. Některé viry, například, tabákový mozaikový virus, má proteinovou plášť sestávající z mnoha polypeptidových řetězců zabalených s vysoce objednaným způsobem.
Pod působením různých fyzikálně-chemickými faktory (akce koncentrovaných kyselin a zásad, těžkých kovů, vysokých teplot atd.), A proto se mohou vlastnosti molekul proteinů lišit. Proces porušení přirozené struktury proteinu nebo rozložení polypeptidového řetězce bez narušení peptidových vazeb se nazývá denaturace Protein (obr. 2). Denaturace je zpravidla nevratná, avšak v prvních fázích podléhá pozastavení působení negativních faktorů, může protein obnovit svou počáteční strukturu - tento proces se nazývá renatura veverka. Proces zničení primární struktury proteinu je vždy nevratný, nazývá se ničení proteinu.
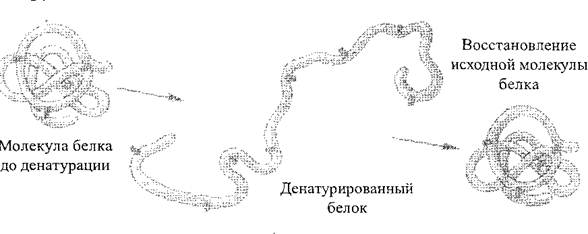
Obr. 2. Schéma procesu denaturace proteinů
Fyzikální a chemické vlastnosti proteinů jsou velmi rozmanité: Proteiny jsou hydrofilní a hydrofobní, jeden z nich snadno mění svou strukturu v důsledku i menších účinků faktorů prostředí, jiné jsou odolné vůči těmto faktorům. Ve fyzikálních a chemických vlastnostech jsou proteiny rozděleny do jednoduchých (proteinů) a komplexu (proteidy).
Jednoduché proteiny sestávají výhradně z aminokyselinových zbytků, sloučenina také zahrnují další přírodní sloučeniny, jako jsou zbytkové fosforečné a nukleové kyseliny, sacharidy, lipidy atd.
Biologické funkce proteinů jsou extrémně rozmanité. Nejdříve vykonávají konstrukce funkce. Proteiny jsou nedílnou součástí buněčných membrán, z nichž takové non-emblémy buněk buněk, jako mikrotubuly a mikrony, složky buněčné skeletry (cytoskeleton) sestávají. Od proteinů, které mají sílu a pružnost, sestávají z chrupavky, šlachy, vazů. Od odolného a nerozpustného proteinu keratinu postavil nehty, peří. Kromě konstrukce také provádějí proteiny ochranný Funkce, která leží, je jak v prevenci poškození buněk, orgánů a organismu jako celku a v ochraně těla od parazitů a mimozemských proteinů. V těle obratlovců jsou vytvořeny ochranné proteiny - protilátky. Jedná se o specializované proteiny, které jsou produkovány krevními lymfocyty. Jsou schopni "rozpoznat" a neutralizovat bakterie, viry, cizí těleso proteinů. Fibrinský krevní protein způsobuje její koagulaci, chrání tělo před velkým ztrátou krve.
Regulační Funkce proteinů je schopnost regulovat aktivitu metabolismu za použití proteinových přírodních hormonů, stejně jako proteinové enzymy. Proteiny provádějí I. signál funkce. Skládá se ve schopnosti jednotlivých komplexních proteinů, které jsou součástí buněčné membrány, "rozpoznat" specifické chemické sloučeniny a reagují na ně: vázat je, změnou jejich struktury, vysílat signály o přítomnosti těchto látek do jiných oblastí membrány nebo uvnitř buňky. Díky signální funkci proteinů může buňka selektivně absorbovat látky z vnějšího prostředí.
Motor Funkce proteinů spočívá ve schopnosti některých z nich se zmenšuje, čímž se zajistí možnost buněk, tkání, tělesa jako celku změnit svůj tvar, pohybovat se. Vzhledem k takovým proteinům jako aktinem a myosinem, které jsou součástí svalových buněk, svalové vlákno je zkráceno; Turbulinový protein, z něhož mikrotubuly a mikro, zajišťuje pohyb cilií a příchutě eukaryotických buněk.
Některé proteiny mohou být odloženy klecí o rezervě, čímž se provádí malování funkce.
V endospermu semen mnoha druhů rostlin (pšenice, kukuřice, rýže) jsou proteiny, které gerid krmí v prvních fázích svého vývoje. Funkce těchto proteinů lze definovat jako výživný.
Proteiny jsou schopny cvičit doprava Některé látky jak uvnitř buňky, tak uvnitř těla. Například lidský krevní protein a obratlovci zvířata hemoglobin transportuje kyslík od respiračních orgánů do buněk a oxid uhličitý - v opačném směru.
Energie Funkce proteinů je, že když se rozdělí do buňky, uvolňuje se energie. Některé z aminokyselin, které jsou vytvořeny během dělení, se používají pro biosyntézu nových proteinů, a zbytek jsou rozděleny do konečných produktů rozpadu s uvolňováním energie (s plným rozdělením 1 g proteinů, 17,2 KJ energie je uvolněn ).
Jeden z hlavních funkcí proteinu - enzymatický. Enzymy jsou biologické katalyzátory nebo urychlovače chemických reakcí, které procházejí v živém organismu. Jak je známo, rychlost chemických reakcí významně závisí na koncentraci látek, jakož i teploty média, ve kterém tyto reakce pokračují. Pokud se domníváme, že život buňky (tělo) je kombinací obrovského počtu reakcí syntézy a rozpadu, který tvoří metabolismus, obrovskou roli protein-enzymů v procesech živobytí těla vůbec úrovně se stávají jasnými. Pouze v důsledku enzymů, při relativně nízké teplotě tělesa a nízkou koncentrací látek v jeho buněk a tkáních, chemické reakce proudění s dostatečně vysokou rychlostí (enzymatická reakce proudí 100-1000 krát rychleji než v prostředí bez enzymů) . Katalytická aktivita protein-enzymu způsobuje celou molekulu, ale pouze jeho malou část, nazvaná aktivním centrem. Prostorová struktura aktivních středisku jako klíč k zámku je vhodná ve tvaru do prostorové struktury katalyzované látky (substrátu), která vysvětluje specificitu protein-enzymů (obr. 3).
S denaturací molekuly proteinu je struktura aktivních středisku rozbitá a enzym ztrácí svou katalytickou schopnost. Cataláza protein-enzymu, která způsobuje reakci rozdělení peroxidu vodíku (H2022) k kyslíku a vody, ztrácí svou katalytickou aktivitu po vystavení vysokým teplotám. To je důvod, proč kapka peroxidu vodíku, aplikovaný na plátek syrových brambor obsahujících velké množství katalázy, "vaříme" a na vařené brambory - zůstává nezměněn.
Proteiny-enzymy, Způsobením průchodu chemických reakcí zůstávají samy beze změny, jsou někdy ve srovnání s jehlou, která spojuje dva kusy tkaniny dohromady, zatímco zůstává nezměněna.
Enzymy jsou umístěny v určitém způsobem v buňce a v těle jako celku. V kleci jsou enzymy často spojeny s jeho membránami nebo membránami jednotlivých organel (mitochondrie, plastid atd.). Účinek na těle léků, hormonů, jedy, že mohou stimulovat nebo naopak aplikovat jeden nebo jiný enzymatický proces.
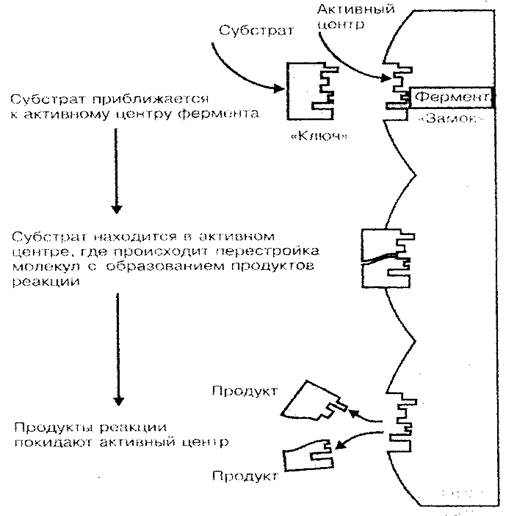
Obr. 3 schéma vazebného enzymu se substrátem
Organismy jsou schopny upravit biosyntézu enzymů. To umožňuje udržovat relativní stálost jejich chemického složení bez ohledu na stále měnící se podmínky prostředí.
Laboratorní práce číslo 1
