Chemická syntéza DNA
Chemická syntéza DNA
V současné době je možné rychle syntetizovat umělé fragmenty nukleových kyselin různé délky a libovolného složení (takové fragmenty jsou tzv. oligonukleotidy), a poté je pomocí speciálních enzymů spojte do delších řetězců. Takto získané geny a jejich fragmenty jsou široce využívány v genetickém inženýrství, biotechnologiích a také pro diagnostiku infekčních a genetických onemocnění. Lze tedy použít chemicky syntetizované oligonukleotidy:
Ke konstrukci celých genů nebo jejich fragmentů
Pro amplifikaci specifických fragmentů DNA
Pro cílené mutace izolované DNA
Jako sondy pro hybridizaci
Jako linkery pro usnadnění klonování.
Připomeňme, že nukleové kyseliny jsou nepravidelné biopolymery skládající se z monomerních struktur – nukleotidů (obr. 29).
Rýže. 29. Složení a struktura nukleotidu.
Tím pádem:
Nukleotid = nukleosid + kyselina fosforečná = dusíkatá báze + pentóza + kyselina fosforečná.
V RNA je pentóza ribóza. V DNA je deoxyribóza.
Složení nukleových kyselin a oligonukleotidů zahrnuje pět nukleotidů, které se od sebe liší strukturou dusíkatého heterocyklu. Tři z nich - deriváty adeninu (A), guaninu (G) a cytosinu (C) jsou obsaženy v DNA i RNA, derivát thyminu (T) - pouze v DNA, uracil (U) - pouze v RNA. Nukleotidy, na rozdíl od nukleosidů, obsahují zbytek kyseliny fosforečné. Nukleotidy jsou navzájem spojeny do polymerního řetězce pomocí fosfodiesterových vazeb (obr. 30). Dusíkaté báze se nepodílejí na spojování nukleotidů jednoho řetězce.
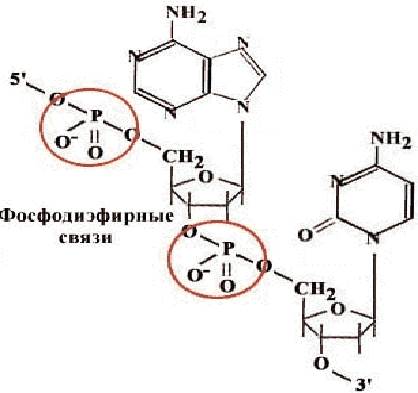
Rýže. 30. Schéma spojování nukleotidů pomocí fosfodiesterové vazby
Úkolem chemické syntézy nukleových kyselin je kombinace jejich monomerů v přesně definovaném pořadí. Aby se vytvořila internukleotidová vazba, musí se dva nukleotidy spojit s odstraněním molekuly vody. Výsledný dimer dále reaguje s dalším monomerem (nukleotidem) za vzniku trimeru atd. K provedení těchto reakcí musí být splněny následující podmínky.
1. Je nutné dosáhnout selektivity při spojování monomerních jednotek. Například hydroxylová skupina prvního nukleotidu musí interagovat s fosfátovým zbytkem druhého, ale ne naopak, protože Jedním z principů konstrukce polynukleotidů v přírodě je unipolarita, tzn. spojení monomerů vždy ve směru 5" → 3" . K tomu musí být fragmenty, které se neúčastní reakce, blokovány pomocí speciálních chránících skupin.
2. Hydroxylové a fosfátové skupiny v nukleotidech samy o sobě navzájem nereagují. K provedení kondenzace monomerů musí být aktivována fosfátová skupina.
3. Protože se syntéza provádí v několika stupních, každá reakce musí probíhat ve velmi vysokém výtěžku.
4. Všechny procesy - zavedení a odstranění ochranných skupin, aktivace a kondenzace - musí být prováděny za mírných podmínek, to znamená bez použití vysokých teplot, stejně jako koncentrovaných roztoků kyselin nebo zásad, které by mohly vést k tvorbě vedlejších produktů a zničení stávajících i nově vzniklých chemických vazeb.
V současné době bylo vyvinuto velké množství způsobů syntézy oligonukleotidů, které splňují tyto podmínky, byly vybrány vhodné chránící skupiny a byly navrženy způsoby aktivace fosfátové skupiny.
Syntéza prodloužených fragmentů nukleových kyselin se skládá z velkého počtu stupňů. Po každé chemické reakci je nutné výsledný produkt izolovat, očistit od nezreagovaných výchozích látek a dalších nečistot. To činí proces dlouhým a pracným a také vede ke značným ztrátám v každé fázi izolace.
Americký vědec Robert Merrifield v roce 1962 navrhl původní myšlenku metody syntézy v pevné fázi, která umožnila dramaticky zjednodušit a urychlit proces. Myšlenka je taková, že první monomer (nukleosid) je navázán na nerozpustný polymerní nosič (pevná fáze), který je umístěn v kolonovém reaktoru. Kolonou prochází roztok obsahující druhý monomer a další nezbytná činidla. V tomto případě se výsledný reakční produkt také zdá být připojen k pevné fázi. Kolona se potom promyje rozpouštědlem, aby se odstranily nezreagované látky a vedlejší produkty, načež se další monomer nechá projít reaktorem, přičemž se postup mnohokrát opakuje, dokud není dokončena syntéza požadovaného produktu. Během procesu syntézy je tedy rostoucí polymerní řetězec fixován na pevné fázi a všechny reakce s ostatními složkami v roztoku probíhají na povrchu nosiče. Tato technika umožňuje nahradit složité a pracné postupy separace a čištění meziproduktů základními operacemi promývání polymerů.
Syntéza zahrnuje několik základních fází.
Fáze 1. Získání chráněných monomerů, které jsou výchozími bloky pro konstrukci oligonukleotidového řetězce. K tomu jsou ty fragmenty molekul, které by neměly podléhat chemickým přeměnám, blokovány speciálními ochrannými skupinami.
Stupeň 2. Připojení koncového monomeru (chráněného nukleosidu) k polymernímu nosiči. Nosné kuličky s připojeným koncovým monomerem se zavedou do reaktorové kolony.
Krok 3: Odstranění chránící skupiny z koncového monomeru. K tomu se kolonou vede roztok činidla, které způsobí odstranění chránící skupiny.
Stupeň 4. Provedení kondenzace, při které kolonou prochází roztok druhého monomeru smíchaný s aktivačním činidlem.
Fáze 3 a 4 se mnohokrát opakují, dokud se nezíská biopolymer požadované délky. Poté se provedou fáze 5 a 6.
Stupeň 5. Reakce nosiče s činidly vedoucí k odštěpení syntetizovaného produktu z pevné fáze a odstranění všech ochranných skupin.
Fáze 6. Izolace a purifikace syntetizovaného fragmentu nukleové kyseliny pomocí různých chromatografických a elektroforetických metod. (Vzhledem k neúplnosti reakcí se ke konci syntézy na nosiči hromadí fragmenty kratších řetězců, takže je nutné pečlivé čištění konečného produktu).
Hlavní příspěvek k rozvoji syntézy oligonukleotidů měl G. Korana, který na počátku 60. let provedl chemickou syntézu fragmentů nukleové kyseliny dané sekvence a za tuto práci obdržel v roce 1968 Nobelovu cenu. V roce 1970 poprvé syntetizoval kompletní gen RNA pro přenos alaninu.
V roce 1975 navrhl R. Letsinger novou metodu tvorby internukleotidových vazeb, na jejímž základě vyvinul počátkem 80. let M. Caruthers tzv. amidofosfitovou nebo fosforamiditovou metodu pro syntézu oligonukleotidů na pevné fázi. Od té doby začal prudký rozvoj této metody a její automatizace.
Počátečními stavebními kameny pro syntézu oligonukleotidů jsou modifikované deoxyribonukleosidy (amidofosfity nebo fosforamidity). Tyto sloučeniny obsahující trojmocný fosfor jsou aktivnější ve srovnání s deriváty pětimocného fosforu (obr. 31).
Amidofosforitanové monomery se získávají z chráněných nukleosidů. Modifikace spočívá v přidání benzenové skupiny k aminoskupinám deoxyadenosinu a deoxycidinu a isobutyralové skupiny k aminoskupině deoxyguanosinu. Thymidin, který postrádá aminoskupinu, není modifikován. Tato modifikace je nezbytná pro ochranu nukleosidů před nežádoucími vedlejšími účinky.
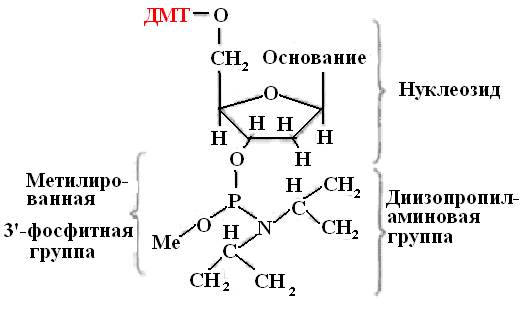
Rýže. 31. Strukturní vzorec fosforamiditu
Takové deriváty všech čtyř bází - A, T, G a C - se používají pro chemickou syntézu DNA.
DMT – dimethoxytrityl
Me – methylová skupina
Syntéza probíhá v pevné fázi, rostoucí řetězec DNA je fixován na pevném nosiči, což umožňuje provádět všechny reakce v jedné nádobě, po každé fázi snadno smývat nepotřebná činidla a přidávat nová v optimálním množství pro úplný průběh reakce. První nukleosid je fixován na pevný nosič pomocí chemikálie spacer(Obrázek 32). Typicky se jedná o porézní skleněné kuličky s póry stejné velikosti.
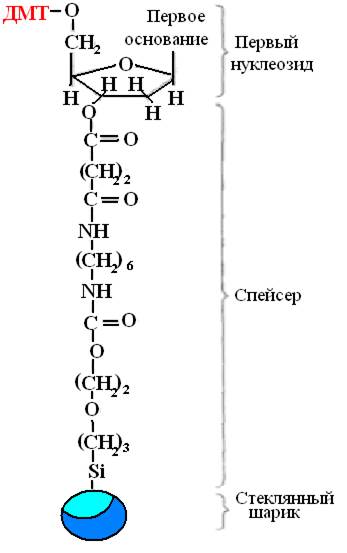
Rýže. 32. První nukleosid fixovaný spacerem.
Po n cyklech provedených podle schématu syntézy (obr. 33) se vytvoří jednovláknový fragment DNA o n+1 nukleotidech
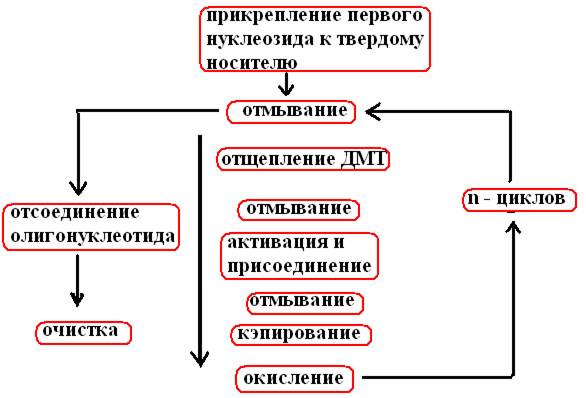
Rýže. 33. Schéma chemické syntézy oligonukleotidu
Cyklus začíná poté, co se první nukleosid připojí ke skleněné kuličkě
Promyje se bezvodým rozpouštědlem (acetonitril), jehož zbytky se odstraní profouknutím argonem.
Promyjte TCA (kyselina trichloroctová), abyste odstranili DMT (detritylace)
Znovu se promyjí rozpouštědlem a TCA, propláchnou argonem a v této fázi se zavede další nukleosid ve formě fosforimiditu a tetrazolu, který aktivuje fosforamidit, nenavázaná činidla se odstraní propláchnutím argonem.
Protože na konci prvního stupně nejsou všechny nukleosidy fixované na nosiči vázány na fosforamidit, je nutné zabránit jejich interakci s nukleosidem přidaným ve druhém stupni. K tomu je nezreagovaná 5'–OH skupina acetylována anhydridem kyseliny octové a dimethylaminopyridinem (capping).
Nestabilní fosfitetriesterová vazba vytvořená ve druhém stupni mezi nukleotidy se oxiduje na pětimocný fosfáttriester pomocí směsi jodu.
Všechny popsané operace se provádějí až do přidání posledního nukleosidu do rostoucího řetězce v souladu s programem.
Methylové skupiny se odstraňují chemickým zpracováním přímo v reakční koloně. Poté se oligonukleotidy oddělí od molekuly spaceru spolu s 3'-OH koncem a eluují se z kolony; potom se postupně odstraní benzoylové, isobutyralové a DMT skupiny. 5' konec řetězce je fosforylován enzymaticky (polynukleotidkináza + ATP) nebo chemicky
Důležitou výhodou metody syntézy v pevné fázi je jednoduchost operací. Proces syntézy sestává z opakovaných kroků průchodu chráněných monomerů, činidel a rozpouštědel přes sloupec polymerního nosiče, ke kterému je připojen rostoucí řetězec. To umožňuje automatizaci procesů.
Automatické syntetizéry zahrnují reaktor obsahující nosič s prvním monomerem připojeným k němu a nádoby s nezbytnými monomery, činidly a rozpouštědly. Pomocí čerpadla se roztoky z těchto nádob střídavě přivádějí do reaktoru v souladu se stávajícím programem a specifikovanou sekvencí syntetizovaného proteinu nebo fragmentu nukleové kyseliny. V současné době vyrábí automatické syntetizátory peptidů a oligonukleotidů různé, včetně tuzemských, společnosti.
Sekvenování DNA
Komplexní informace o molekule DNA lze získat pouze určením její nukleotidové sekvence. Tento postup se nazývá sekvenování(z angličtiny sekvence). Takže sekvenováním genu, tzn. Po stanovení nukleotidové sekvence konkrétní části DNA je často možné stanovit její funkci porovnáním této nukleotidové sekvence s geny, jejichž funkce je již známa. Bez údajů o nukleotidové sekvenci není možné provádět studie molekulárního klonování, stejně jako vytvoření exprese rekombinantní DNA.
Práce na sekvenování DNA je poměrně drahá. Vyžadují speciální přesné vybavení, vysoce čistá chemická činidla a biologické přípravky a také vysoce kvalifikované specialisty. Potenciál biotechnologie bude plně realizován pouze tehdy, když se její nástroje (včetně sekvenování genomu) stanou stejně dostupnými a levnými jako osobní počítače. Aby se snížily náklady na sekvenování, vývojáři nových metod se snaží snížit počet přípravných kroků, miniaturizovat zařízení na limit a sekvenovat miliony molekul současně.
Než začneme popisovat metody sekvenování, měli bychom si připomenout hlavní body reprodukce nukleotidových sekvencí DNA, tzn. některé základní kroky replikace DNA.
DNA buňky, která se začíná dělit, prochází dramatickými změnami: dvojitá šroubovice se odvíjí a řetězce se rozcházejí. Syntéza komplementárních polynukleotidů začíná na každém řetězci, na jednom je spojitá, na druhém nespojitá. Je katalyzován enzymem zvaným DNA-dependentní DNA polymeráza; další enzym, DNA ligáza, spojuje polynukleotidové fragmenty do souvislého řetězce. Takže z jedné molekuly DNA se vytvoří dvě.
Mnoho metod sekvenování DNA je založeno na vzájemné komplementaritě řetězců této molekuly. Genetická abeceda se skládá pouze ze čtyř písmen – dusíkaté báze adenin (A), cytosin (C), guanin (G) a thymin (T). Báze opačných řetězců molekuly DNA jsou spojeny v souladu s pravidlem komplementarity: A tvoří pár s T a C s G. V důsledku této interakce vzniká známá dvoušroubovice - a konstrukce připomínající točité schodiště (obr. 34).
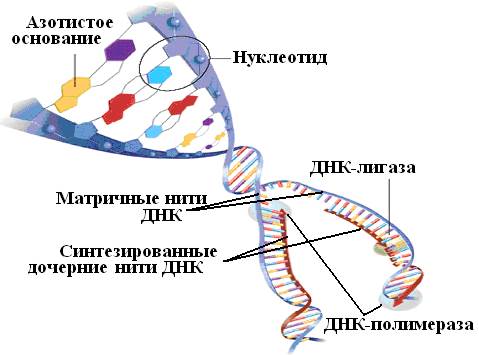
Rýže. 34. Schéma syntézy dceřiných nukleotidových řetězců na obou řetězcích DNA
Živé organismy využívají principu komplementarity při kopírování svého genetického materiálu (replikaci) a opravě jeho poškození (repair). Základem je také amplifikace (viz PCR) fragmentů cílové DNA a jejich následné sekvenování pomocí metody vyvinuté na konci 70. let. F. Sanger.
