Olbaltumvielas: ēka un īpašības. Protekov funkcijas
Starp sarežģītiem biopolimēriem funkcionālajā vērtībā un kvantitatīvajā attiecībās galvenā loma pieder proteīniem. Dzīvnieku šūnā tās veido 40-50% no tās sausās masas, dārzeņos - 20- 35%. Milzīgs dažādas dzīvās būtnes lielā mērā nosaka atšķirības to olbaltumvielas. Tikai cilvēka organismā ir vairāk nekā 5 miljoni veidu. Šādu proteīnu atšķirīgu iemeslu izskaidro to struktūras specifika. Proteīni pārstāvēt polimēri, monomēri kuri ir aminoskābes. Ir zināmi 20 veidu aminoskābes, kas ir daļa no olbaltumvielu molekulām, tos sauc par pamata, lai atšķirtu no citām aminoskābēm, kas atrodas arī organismos, bet ne daļā no olbaltumvielu molekulām. Visām šīm aminoskābēm to molekulu sastāvā ir tāda pati atomu struktūra.
N-dēls, kur Coxy ir karboksilgrupa, NH 2 -
amino grupa.
Ceturto Valented oglekļa obligāciju aizņem tā sauktā radikāļu (R). Dažādu veidu aminoskābju radikāļi atšķiras viens no otra ar ķīmisko struktūru, elektriskajām nodevām, kā arī spēju izšķīdināt ūdenī. Aminoskābes ir amfoteriskie savienojumi, I.E., tā pati aminoskābe var darboties kā skābe un sārmu loma. Skābes īpašības dod viņas karboksilgrupu (Coxy) un sārmainā - amino grupu (NH 2). Pateicoties amfoteritātei, aminoskābes var mijiedarboties savā starpā, un viens no tiem darbojas kā skābe, bet otrs sārmu lomā; Karboksilgrupa viena aminoskābe mijiedarbojas ar Amino Group citu). Aminoskābju savienojums olbaltumvielu nējos tiek veikta uz ilgstošu kovalentu obligāciju rēķina. Šo procesu var rakstīt, izmantojot šādu vienādojumu:
Iegūto savienojumu aminoskābju sauc peptīdu, un kovalentā saikne starp tām - peptīdu saiti. Visi proteīni ir polipeptīdi, ti. ķēdes, kas sastāv no daudziem desmitiem un pat simtiem aminoskābju saites. No 20 veidu aminoskābēm, jūs varat veidot milzīgu daudzumu olbaltumvielu, tāpat kā no 20 burtiem alfabēta var veidot daudz vārdiem, kuras nozīme būs atkarīga no kuriem vēstules tās ir sastādītas, kurās tie ir sastādīti Ir ņemti daudzumi un kādā secībā ir uzstādīti. Proteīna molekulas īpašības nosaka aminoskābju sastāvs, aminoskābju saikņu skaits, kā arī to secība ķēdē.
Aminoskābju atlikumu secība proteīna molekulā nosaka to primārs Struktūra (1. att.-I). Ja mēs uzskatām, ka viena aminoskābju līmeņa lielums ir 0,35-0,37 nm, ir acīmredzams, ka proteīna makromolekulu, kas sastāv no simtiem aminoskābju atlieku, būtu vairāki desmiti nanometri. Patiesībā, proteīnu lielums ir daudz mazāks, jo telpā polipeptīda ķēde ir pilnībā vai daļēji vītā Helix, kas ir sekundārs Proteīna struktūra (1. att.-II). Aminoskābju radikāļi paliek ārpus spirāles ārpusē, un starp NH grupām, kas atrodas vienā kārtā, un kopīgas grupas, kas atrodas blakus spirāles, ūdeņraža saites veidojas. Tie ir daudz vājāki nekā kovalentā, bet atkārtoti atkārtoti sniedz stabilu saķeri. Polipeptīdu spirāle, "izšūts" ar daudzām ūdeņraža saitēm, ir pietiekami stabila struktūra. Polipeptīda spirāle tiek pakļauta turpmākai ieklšanai - tas sabrūk dīvaini, bet katram proteīnam ir pilnīgi un pastāvīgi tā sauktajā pasaulē (bumba), kas ir terciārs Proteīna molekulas struktūra (1. att. III-III).
Terciārās olbaltumvielu struktūru atbalsta trīs veidu obligācijas: jonu, ūdeņraža un disulfīds, kā arī hidrofobās mijiedarbības. Kvantitatīvā izteiksmē hidrofobās attiecības ir vissvarīgākās: Ūdens vidē, šūnas ir hidrofobi radikāļi, atvairīt viens otram. Tādējādi ūdens vide, šķiet, piespiež proteīnu molekulu veikt noteiktu pasūtīto struktūru, kas kļūst bioloģiski aktīva.
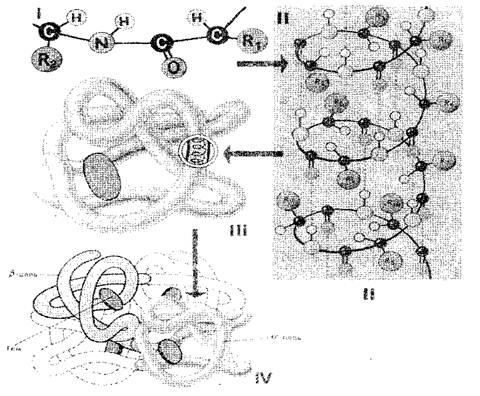
Fig. 1. Proteīna šūnu struktūras shēma: I, II, III, IV - primārais, sekundārais, terciārais, ceturkšņa struktūra
Olbaltumvielas, kas sastāv no viena polipeptīda ķēdes, ir tikai terciārā struktūra. Tomēr daži olbaltumvielas ir veidotas no vairākām polipeptīdu ķēdēm. Par viņiem ieviesa koncepciju kvaternārā struktūra (Att. 1-IV), kas ir viena funkcionāla vienība, kas atrodas gan hidrofobās mijiedarbības, gan ūdeņradi, gan jonu saites. Kvaternārā struktūra ir raksturīga, piemēram, hemoglobīnam. Tās molekula sastāv no četrām atsevišķām polipeptīdu ķēdēm. Dažiem vīrusiem, piemēram, tabakas mozaīkas vīrusu, ir olbaltumvielu korpuss, kas sastāv no daudzām polipeptīdu ķēdēm, kas pildītas ar ļoti pasūtītu ceļu.
Dažādu fizikāli ķīmisko faktoru darbībā (koncentrētu skābju un sārmu, smago metālu, augstu temperatūru uc) struktūra un tāpēc proteīna molekulu īpašības var atšķirties. Proteīna dabiskās struktūras pārkāpšana vai polipeptīda ķēdes izvēršana bez peptīdu saikņu traucējumiem denaturācija Proteīns (2. att.). Parasti denaturācija ir neatgriezeniska, tomēr pirmajos posmos, ievērojot negatīvo faktoru darbības apturēšanu, proteīns var atjaunot sākotnējo struktūru - šo procesu sauc par šo procesu renatura vāvere. Primārās olbaltumvielu struktūras iznīcināšanas process vienmēr ir neatgriezenisks, to sauc par proteīna iznīcināšanu.
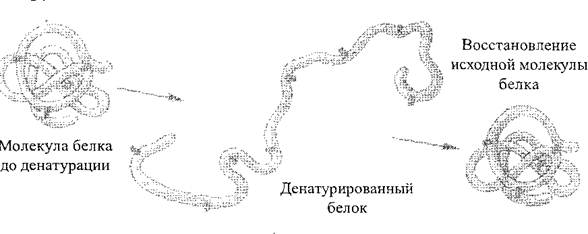
Fig. 2. Proteīna denaturēšanas procesa shēma
Olbaltumvielu fizikālās un ķīmiskās īpašības ir ļoti daudzveidīgas: olbaltumvielas ir hidrofīlas un hidrofobas, viena no tām viegli mainīt savu struktūru pat vides faktoru mazo ietekmi, citi ir izturīgi pret šiem faktoriem. Fizikālajās un ķīmiskajās īpašībās olbaltumvielas ir sadalītas vienkāršās (olbaltumvielās) un kompleksos (protēnvidēs).
Vienkāršas olbaltumvielas sastāv tikai no aminoskābju atliekām, savienojums ietver arī citus dabas savienojumus, piemēram, atlikušās fosforiskās un nukleīnskābes, ogļhidrātus, lipīdus utt.
Olbaltumvielu bioloģiskās funkcijas ir ārkārtīgi daudzveidīgas. Pirmkārt, viņi veic būvniecība funkcija. Olbaltumvielas ir neatņemama šūnu membrānu sastāvdaļa, no kurām šādi šūnu šūnu šūnu, piemēram, mikrotrubī un mikroni, šūnu skeleta (citoskeleta) sastāvdaļas sastāv. No proteīniem, kuriem ir spēks un elastība, sastāv no skrimšļiem, cīpslām, saitēm. No izturīgas un nešķīstošas \u200b\u200bolbaltumvielu keratīna būvēti nagi, spalvas. Papildus būvniecībai, proteīni arī veic aizsargājošs Funkcija, kas slēpjas, ir gan šūnu, orgānu un organisma bojājumu novēršana kopumā un organisma aizsardzībā no parazītiem un svešzemju olbaltumvielām. Mugurkaulnieku korpusā veidojas aizsardzības olbaltumvielas - antivielas. Tie ir specializēti olbaltumvielas, ko ražo asins limfocīti. Viņi spēj "atpazīt" un neitralizēt baktērijas, vīrusus, svešzemju olbaltumvielu ķermeni. Fibrīns Asins proteīns izraisa to koagulāciju, aizsargājot ķermeni no lieliem asins zudumiem.
Regulatīvs Olbaltumvielu funkcija ir spēja regulēt vielmaiņas darbību, izmantojot proteīna dabas hormonus, kā arī olbaltumvielu enzīmus. Proteīni veic I. signāls funkcija. Tā sastāv no individuālu kompleksu proteīnu spējas, kas ir daļa no šūnu membrānas, "atpazīt" īpašus ķīmiskus savienojumus un reaģē uz tiem: lai tie tos saistītu, mainot to struktūru, nosūta signālus par šo vielu klātbūtni citās membrānas apgabalos vai šūnas iekšpusē. Pateicoties proteīnu signāla funkcijai, šūna var selektēt vielas no ārējās vides.
Motors Olbaltumvielu funkcija ir spēja dažu no viņiem sarukt, tādējādi nodrošinot šūnu, audu, ķermeņa kopumā iespēju mainīt savu formu, pārvietoties. Tātad, sakarā ar šādiem proteīniem, kā aktins un miozīns, kas ir daļa no muskuļu šūnām, muskuļu šķiedra ir saīsināta; Turbulīna proteīns, no kura mikrotubule un mikro, nodrošina cilia un ezari šūnu garšu kustību.
Daži proteīni var tikt atlikti ar būru par rezervi, tādējādi veicot glezna funkcija.
Daudzu augu sugu sēklu (kviešu, kukurūzas, rīsu) sēklu endospermā ir olbaltumvielas, kas barojas ar tās attīstības pirmajos posmos. Šo proteīnu funkciju var definēt kā barojošs.
Proteīni spēj izmantot transports Dažas vielas gan šūnas iekšpusē, gan ķermeņa iekšpusē. Piemēram, cilvēka asins olbaltumvielu un mugurkaulnieku hemoglobīna pārvadā skābekli no elpošanas orgāniem uz šūnām un oglekļa dioksīdu - pretējā virzienā.
Enerģija Olbaltumvielu funkcija ir tā, ka, sadalot šūnā, enerģija tiek atbrīvota. Dažas no aminoskābēm, kas veidojas sadalīšanas laikā, tiek izmantotas jauno proteīnu biosintēzei, un pārējie ir sadalīti līdz galīgajiem bojājumiem ar enerģijas atbrīvošanu (ar pilnu sadalīšanu 1 g olbaltumvielu, 17.2 kJ enerģijas tiek atbrīvota ).
Viena no galvenajām olbaltumvielu funkcijām - fermentu. Enzīmi ir bioloģiskie katalizatori vai ķīmisko reakcijas paātrinātāji, kas iet dzīvā organismā. Kā zināms, ķīmisko reakciju likme būtiski ir atkarīga no vielu koncentrācijas, kā arī vidēja temperatūru, kurā šīs reakcijas turpinās. Ja mēs uzskatām, ka šūnas (ķermeņa) dzīve ir milzīga sintēzes un bojājumu reakciju kombinācija, kas veido vielmaiņu, olbaltumvielu-fermentu milzīgo lomu organisma iztikas līdzekļu procesos vispār līmenis kļūst skaidrs. Tikai sakarā ar fermentiem, salīdzinoši zemā temperatūrā ķermeņa un zemu koncentrāciju vielu tās šūnās un audos, ķīmiskās reakcijas plūsma ar pietiekami lielu ātrumu (fermentatīvā reakcija plūst 100-1000 reizes ātrāk nekā vidē bez fermentiem) . Proteīna-enzīma katalītiskā aktivitāte izraisa ne visu molekulu, bet tikai tās mazo daļu, ko sauc par aktīvo centru. Aktīvā centra telpiskā struktūra kā bloķēšanas atslēga ir piemērota katalizēta vielas (substrāta) telpiskajai struktūrai, kas izskaidro proteīna-fermentu specifiku (3. att.).
Ar proteīna molekulas denaturāciju aktīvā centra struktūra ir bojāta, un ferments zaudē katalītisko spēju. Tādējādi olbaltumvielu-enzīmu katalāze, kas izraisa ūdeņraža peroksīda sadalīšanas reakciju uz skābekli un ūdeni zaudē katalītisko aktivitāti pēc augstas temperatūras iedarbības. Tāpēc ūdeņraža peroksīda piliens, ko piemēro neapstrādātu kartupeļu šķēlītei, kas satur lielu katalāzes daudzumu, "vārās", un vārītiem kartupeļiem - tas paliek nemainīgs.
Proteīni-fermenti, Izraisot ķīmisko reakciju pāreju, viņi paši paliek nemainīgi, tie dažkārt tiek salīdzināti ar adatu, kas savieno divus auduma gabalus kopā, bet tas paliek nemainīgs.
Fermenti atrodas noteiktā veidā šūnā un ķermenī kopumā. Būrī fermenti bieži ir saistīti ar atsevišķu organuļu membrānām vai membrānām (mitohondrijiem, plastimt uc). Ietekme uz narkotiku, hormonu, indes ir tāda, ka viņi var stimulēt vai, gluži pretēji, injicēt vienu vai citu fermentu procesu.
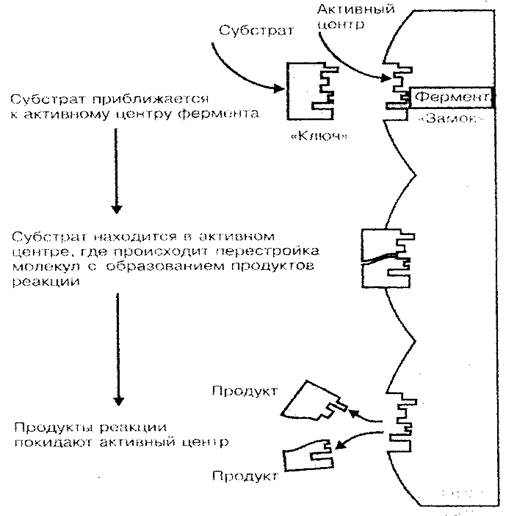
Fig. 3 Enzīmu saistīšanās shēma ar substrātu
Organismi spēj pielāgot fermentu biosintēzi. Tas ļauj saglabāt savu ķīmiskās sastāva relatīvo noturību neatkarīgi no arvien mainīgajiem vides apstākļiem.
Laboratorijas darba numurs 1
