DNS ķīmiskā sintēze
DNS ķīmiskā sintēze
Šobrīd diezgan ātri var sintezēt dažāda garuma un jebkura sastāva mākslīgos nukleīnskābju fragmentus (tādus fragmentus sauc oligonukleotīdi), un pēc tam apvienojiet tās garākās ķēdēs, izmantojot īpašus fermentus. Šādi iegūtos gēnus un to fragmentus plaši izmanto gēnu inženierijā, biotehnoloģijā, kā arī infekcijas un ģenētisko slimību diagnostikā. Tātad var izmantot ķīmiski sintezētus oligonukleotīdus:
Veselu gēnu vai to fragmentu konstruēšanai
Specifisku DNS fragmentu amplifikācijai
Izolētas DNS virzītām mutācijām
Kā zondes hibridizācijai
Kā linkeri klonēšanas atvieglošanai.
Atgādinām, ka nukleīnskābes ir neregulāri biopolimēri, kas sastāv no monomēru struktūrām – nukleotīdiem (29. att.).
Rīsi. 29. Nukleotīda sastāvs un struktūra.
Tādējādi:
Nukleotīds \u003d nukleozīds + fosforskābe \u003d slāpekļa bāze + pentoze + fosforskābe.
RNS pentoze ir riboze. DNS satur dezoksiribozi.
Nukleīnskābju un oligonukleotīdu sastāvā ietilpst pieci nukleotīdi, kas atšķiras viens no otra ar slāpekļa heterocikla struktūru. Trīs no tiem - adenīna (A), guanīna (G) un citozīna (C) atvasinājumi ir iekļauti gan DNS, gan RNS, timīns (T) - tikai DNS, uracils (U) - tikai RNS. Nukleotīdi, atšķirībā no nukleozīdiem, satur fosforskābes atlikumu. Nukleotīdi ir savienoti viens ar otru polimēra ķēdē, izmantojot fosfodiestera saites (30. att.). Slāpekļa bāzes nepiedalās vienas ķēdes nukleotīdu savienošanā.
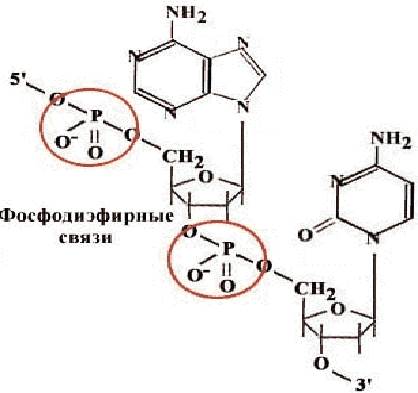
Rīsi. 30. Nukleotīdu savienošanas shēma, izmantojot fosfodiestera saiti
Nukleīnskābju ķīmiskās sintēzes uzdevums ir tos veidojošo monomēru kombinācija stingri noteiktā secībā. Lai izveidotu starpnukleotīdu saiti, divi nukleotīdi jāsavieno ar ūdens molekulas elimināciju. Pēc tam iegūtais dimērs reaģē ar nākamo monomēru (nukleotīdu), veidojot trimeru utt. Lai šīs reakcijas notiktu, ir jāievēro šādi nosacījumi.
1. Nepieciešams panākt monomēra vienību savienojuma selektivitāti. Piemēram, pirmā nukleotīda hidroksilgrupai vajadzētu mijiedarboties ar otrā nukleotīda fosfāta atlikumu, bet ne otrādi, jo viens no polinukleotīdu veidošanas principiem dabā ir unipolaritāte, t.i. monomēra savienojums vienmēr virzienā 5" → 3" . Šim nolūkam fragmenti, kas nepiedalās reakcijā, ir jābloķē, izmantojot īpašas aizsarggrupas.
2. Hidroksilgrupas un fosfātu grupas pašas par sevi nukleotīdos nereaģē savā starpā. Lai veiktu monomēru kondensāciju, ir jāaktivizē fosfātu grupa.
3. Tā kā sintēze tiek veikta vairākos posmos, katrai reakcijai jānotiek ar ļoti augstu iznākumu.
4. Visi procesi - aizsarggrupu ievadīšana un noņemšana, aktivizēšana un kondensācija - jāveic maigos apstākļos, tas ir, neizmantojot augstas temperatūras, kā arī koncentrētus skābju vai sārmu šķīdumus, kas var izraisīt blakusproduktu veidošanās un esošo un jaunizveidoto ķīmisko saišu iznīcināšana.
Šobrīd ir izstrādāts liels skaits oligonukleotīdu sintēzes metožu, kas atbilst šiem nosacījumiem, ir izvēlētas ērtas aizsarggrupas un piedāvātas metodes fosfātu grupas aktivēšanai.
Paplašinātu nukleīnskābju fragmentu sintēze sastāv no daudziem posmiem. Pēc katras ķīmiskās reakcijas veikšanas iegūtais produkts ir jāizolē, attīrot to no nereaģējušām izejvielām un citiem piemaisījumiem. Tas padara procesu ilgu un darbietilpīgu, kā arī rada ievērojamus zaudējumus katrā izolācijas posmā.
Amerikāņu zinātnieks Roberts Merifīlds 1962. gadā ierosināja sākotnējo ideju par cietfāzes sintēzes metodi, kas ļāva krasi vienkāršot un paātrināt procesu. Ideja ir tāda, ka pirmais monomērs (nukleozīds) ir pievienots nešķīstoša polimēra nesējam (cietai fāzei), kas tiek ievietots reaktora kolonnā. Caur kolonnu tiek izvadīts šķīdums, kas satur otro monomēru un citus nepieciešamos reaģentus. Šajā gadījumā iegūtais reakcijas produkts arī izrādās piesaistīts cietajai fāzei. Pēc tam kolonnu mazgā ar šķīdinātāju, lai noņemtu neizreaģējušās vielas un blakusproduktus, pēc tam caur reaktoru tiek izvadīts nākamais monomērs, atkārtojot procedūru daudzas reizes, līdz tiek pabeigta vēlamā produkta sintēze. Tādējādi augošā polimēra ķēde sintēzes laikā tiek fiksēta uz cietās fāzes, un visas reakcijas ar citiem komponentiem šķīdumā notiek uz atbalsta virsmas. Šis paņēmiens ļauj aizstāt sarežģītas un laikietilpīgas starpproduktu atdalīšanas un attīrīšanas procedūras ar elementārām polimēru mazgāšanas operācijām.
Sintēze ietver vairākus pamata posmus.
1. posms. Aizsargātu monomēru iegūšana, kas ir starta bloki oligonukleotīdu ķēdes veidošanai. Lai to izdarītu, tie molekulu fragmenti, kuriem nevajadzētu veikt ķīmiskas transformācijas, tiek bloķēti ar īpašām aizsarggrupām.
2. darbība: gala monomēra (aizsargātā nukleozīda) pievienošana polimēra nesējam. Nesējgranulas ar pievienotu gala monomēru tiek ievadītas reaktora kolonnā.
3. solis: termināla monomēra aizsardzības noņemšana. Lai to izdarītu, caur kolonnu tiek izvadīts reaģenta šķīdums, izraisot aizsarggrupas likvidēšanu.
4. posms. Kondensācija, kurai caur kolonnu tiek izvadīts otrā monomēra šķīdums, kas sajaukts ar aktivējošo reaģentu.
3. un 4. darbību atkārto daudzas reizes, līdz tiek iegūts vajadzīgā garuma biopolimērs. Pēc tam tiek veikta 5. un 6. darbība.
5. posms. Atbalsta apstrāde ar reaģentiem, kas noved pie sintezētā produkta atdalīšanas no cietās fāzes un visu aizsarggrupu noņemšanas.
6. posms. Sintezētā nukleīnskābes fragmenta izdalīšana un attīrīšana, izmantojot dažādas hromatogrāfijas un elektroforēzes metodes. (Reakciju nepabeigtības dēļ sintēzes beigās uz balsta uzkrājas īsāki ķēdes fragmenti, tāpēc ir nepieciešama rūpīga gala produkta attīrīšana).
Galveno ieguldījumu oligonukleotīdu sintēzes attīstībā sniedza G. Korana, kurš 60. gadu sākumā veica noteiktas secības nukleīnskābju fragmentu ķīmisko sintēzi un par šo darbu 1968. gadā saņēma Nobela prēmiju. 1970. gadā viņš pirmo reizi sintezēja pilnīgu alanīna pārneses RNS gēnu.
1975. gadā R. Letsingers ierosināja jaunu metodi starpnukleotīdu saites veidošanai, uz kuras pamata 80. gadu sākumā M. Karuters izstrādāja tā saukto cietās fāzes amidofosfīta jeb fosforamidīta metodi oligonukleotīdu sintēzei. Kopš tā laika sākās strauja šīs metodes attīstība un tās automatizācija.
Sākotnējie oligonukleotīda sintēzes celtniecības bloki ir modificētie dezoksiribonukleozīdi (amidofosfīti vai fosforamidīti). Šie trīsvērtīgo fosforu saturošie savienojumi ir aktīvāki nekā piecvērtīgā fosfora atvasinājumi (31. att.).
Amidofosfīta monomērus iegūst no aizsargātiem nukleozīdiem. Modifikācija sastāv no benzola grupas pievienošanas dezoksiadenozīna un deoksicidīna aminogrupām un izobutirāla grupas pievienošanu deoksiguanozīna aminogrupai. Timidīns, kuram trūkst aminogrupas, netiek modificēts. Šī modifikācija ir nepieciešama, lai aizsargātu nukleozīdus no nevēlamām blakusparādībām.
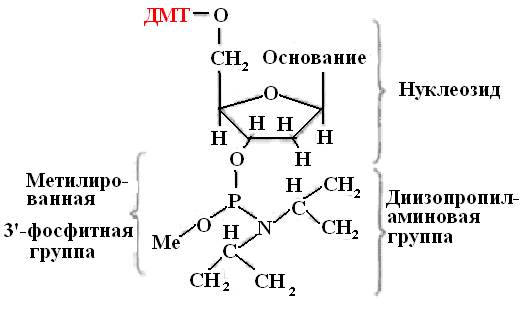
Rīsi. 31.Fosforamidīta strukturālā formula
Šādus visu četru bāzu - A, T, G un C atvasinājumus izmanto DNS ķīmiskajai sintēzei.
DMT - dimetoksitritils
Es - metilgrupa
Sintēze tiek veikta cietā fāzē, augošā DNS ķēde tiek fiksēta uz cieta nesēja, kas ļauj veikt visas reakcijas vienā traukā, pēc katra posma viegli izskalot nevajadzīgos reaģentus un pievienot jaunus optimālā daudzumā. pilnīga reakcija. Pirmais nukleozīds tiek piestiprināts pie cieta balsta ar ķīmisku palīdzību starplikas(32. attēls). Parasti tās ir porainas stikla lodītes ar vienāda izmēra porām.
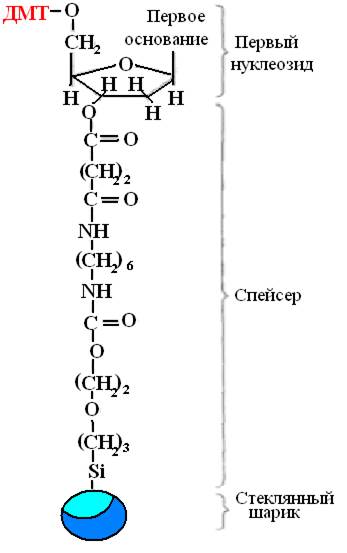
Rīsi. 32.Pirmais nukleozīds fiksēts ar starpliku.
Pēc n cikliem, kas veikti saskaņā ar sintēzes shēmu (33. att.), no n + 1 nukleotīda veidojas vienpavedienu DNS fragments.
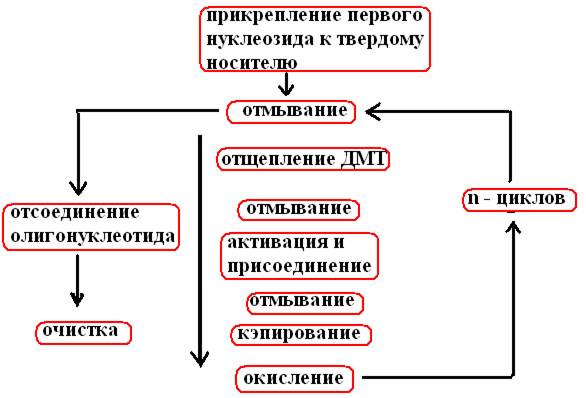
Rīsi. 33. Oligonukleotīda ķīmiskās sintēzes shēma
Cikls sākas pēc pirmā nukleozīda piestiprināšanas stikla lodītēm
Mazgāts ar bezūdens šķīdinātāju (acetonitrilu), kura paliekas tiek noņemtas, attīrot ar argonu
Mazgāts ar TCA (trihloretiķskābi), lai noņemtu DMT (detritilāciju)
To atkal mazgā ar šķīdinātāju un TCA, iztīra ar argonu, un šajā posmā tiek ievadīts nākamais nukleozīds fosforimidīta un tetrazola veidā, kas aktivizē fosforamidītu, nesaistītos reaģentus atdala, iztīrot argonu.
Tā kā pirmā posma beigās ne visi atbalstītie nukleozīdi ir saistīti ar fosforamidītu, ir jānovērš to mijiedarbība ar otrajā posmā pievienoto nukleozīdu. Lai to izdarītu, nereaģējušo 5'-OH grupu acetilē ar etiķskābes anhidrīdu un dimetilaminopiridīnu (aizverot).
Nestabilā fosfīta triestera saite, kas veidojas otrajā posmā starp nukleotīdiem, tiek oksidēta ar joda maisījumu par piecvērtīgu fosfāta triesteri.
Visas aprakstītās darbības tiek veiktas, līdz augšanas ķēdē saskaņā ar programmu tiek pievienots pēdējais nukleozīds.
Metilgrupas tiek noņemtas, ķīmiski apstrādājot tieši reakcijas kolonnā. Pēc tam oligonukleotīdus atdala no starplikas molekulas kopā ar 3'-OH galu un eluē no kolonnas; tad secīgi tiek noņemtas benzoilgrupas, izobutirāls un DMT. Ķēdes 5'-gals tiek fosforilēts ar fermentatīvu (polinukleotīdu kināze + ATP) vai ķīmisku metodi
Svarīga cietās fāzes sintēzes metodes priekšrocība ir darbību vienkāršība. Sintēzes process sastāv no atkārtotiem aizsargāto monomēru, reaģentu un šķīdinātāju izvadīšanas soļiem caur kolonnu ar polimēra nesēju, kam pievienota augšanas ķēde. Tas ļauj automatizēt procesu.
Automātiskajos sintezatoros ietilpst reaktors, kurā ir nesējs, kuram ir pievienots pirmais monomērs, un trauki ar nepieciešamajiem monomēriem, reaģentiem un šķīdinātājiem. Ar sūkņa palīdzību šķīdumi no šiem traukiem pārmaiņus tiek ievadīti reaktorā saskaņā ar pieejamo programmu un doto sintezējamā proteīna vai nukleīnskābes fragmenta secību. Pašlaik automātiskos peptīdu un oligonukleotīdu sintezatorus ražo dažādi uzņēmumi, tostarp vietējie.
DNS sekvencēšana
Visaptverošu informāciju par DNS molekulu var iegūt, tikai nosakot tās nukleotīdu secību. Šo procedūru sauc sekvencēšana(no angļu valodas. secība). Tādējādi, sekvenējot gēnu, t.i. pēc noteiktas DNS sadaļas nukleotīdu secības noteikšanas bieži vien ir iespējams noteikt tās funkciju, salīdzinot šo nukleotīdu secību ar nukleotīdu secību gēniem, kuru funkcija jau ir zināma. Bez datiem par nukleotīdu secību nav iespējams veikt pētījumus par molekulāro klonēšanu, kā arī ekspresijas rekombinantās DNS izveidi.
DNS sekvencēšana ir diezgan dārga. Tiem nepieciešams īpašs precizitātes aprīkojums, īpaši tīras ķīmiskas vielas un bioloģiskie preparāti, kā arī augsti apmācīti speciālisti. Biotehnoloģijas potenciāls tiks pilnībā realizēts tikai tad, kad tās instrumenti (tostarp genoma sekvencēšana) kļūs tikpat pieejami un lēti kā personālie datori. Lai samazinātu sekvencēšanas procedūras izmaksas, jaunu metožu izstrādātāji cenšas samazināt sagatavošanās posmu skaitu, miniaturizēt iekārtas līdz robežai un vienlaicīgi secināt miljoniem molekulu.
Pirms ķerties pie sekvencēšanas metožu apraksta, ir jāatgādina galvenie DNS nukleotīdu secību reproducēšanas punkti, t.i. daži galvenie DNS replikācijas soļi.
Šūnas DNS, kas sāk dalīties, piedzīvo kardinālas izmaiņas: dubultā spirāle atritinās, ķēdes atšķiras. Katrā ķēdē sākas komplementāro polinukleotīdu sintēze, vienā - nepārtraukta, otrajā - pārtraukta. To katalizē enzīms, ko sauc par DNS atkarīgo DNS polimerāzi; cits enzīms, DNS ligāze, saista polinukleotīdu fragmentus nepārtrauktā ķēdē. Tātad no vienas DNS molekulas veidojas divas.
Daudzas DNS sekvencēšanas metodes ir balstītas uz šīs molekulas ķēžu savstarpēju komplementaritāti. Ģenētiskais alfabēts sastāv tikai no četriem burtiem – adenīna (A), citozīna (C), guanīna (G) un timīna (T) slāpekļa bāzes. DNS molekulas pretējo virkņu bāzes ir savienotas saskaņā ar komplementaritātes likumu: A veido pāri ar T, bet C ar G. Šīs mijiedarbības rezultātā veidojas labi zināmā dubultspirāle - a konstrukcija, kas atgādina spirālveida kāpnes (34. att.).
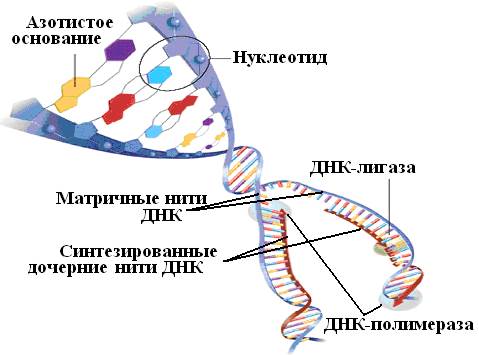
Rīsi. 34. Shēma meitas nukleotīdu ķēžu sintēzei uz abām DNS ķēdēm
Dzīvi organismi izmanto komplementaritātes principu, lai kopētu savu ģenētisko materiālu (replikācija) un labotu tā bojājumus (remonts). Tas arī ir pamatā mērķa DNS fragmentu amplifikācijai (skatīt PCR) un to sekojošai sekvencēšanai, izmantojot metodi, kas izstrādāta 1970. gadu beigās. F. Sanger.
