Beljakovine: Zgradba in lastnosti. PROTEKOV FUNKCIJE
Med kompleksnimi biopolimeri v funkcionalni vrednosti in v količinskem razmerju je glavna vloga beljakovin. V živalski celici predstavljajo 40-50% svoje suhe mase, v zelenjavi - 20-- 35%. Veliko različnih živih bitij je v veliki meri odvisna od razlik v njihovih beljakovinah. Samo v človeškem telesu je več kot 5 milijonov tipov. Razlog za tako različne beljakovine je pojasnjen s posebnostmi njihove strukture. Beljakovine zastopnik polimeri, monomers. ki so amino kisline. Znano je 20 vrst aminokislin, ki so del molekul beljakovin, ki se imenujejo osnovne, da bi razlikovali od drugih aminokislin, ki so prisotne tudi v organizmih, vendar ne del beljakovinskih molekul. Vse te aminokisline v sestavi svojih molekul imajo enako strukturo atomov.
N-Son, kjer je koxy je karboksilna skupina, NH 2 -
amino skupina.
Četrta varended ogljikove vezi, ki jo zaseda tako imenovani radikal (R). Radikali različnih vrst aminokislin se med seboj razlikujejo po kemijski strukturi, električnih stroških, kot tudi v sposobnosti raztopitve v vodi. Aminokisline so amfoterne spojine, i.e., enaka aminokislina lahko deluje kot kislina in vloga alkalija. Kislinske lastnosti dajejo ji karboksilno skupino (coxy) in alkalno-amino skupino (NH 2). Zahvaljujoč amfoterstvu lahko aminokisline med seboj komunicirajo, ena od njih pa deluje kot kislina, druga pa v vlogi alkalijev; Karboksilna skupina ene aminokisline sodeluje z amino skupino drugo). Spojina aminokislin v ledvicah beljakovin izvedemo na račun trajnih kovalentnih vezi. Ta postopek je mogoče napisati s takšno enačbo:
Nastala spojina aminokislin se imenuje peptid in kovalentna vez med njimi - peptidna vez. Vsi beljakovini so polipeptidi, i.e. verige, ki sestojijo iz številnih desetine in celo na stotine aminokislinskih povezav. Od 20 vrst aminokislin, lahko zgradite ogromno količino beljakovin, prav tako od 20 črk abecede lahko sestavljajo veliko besed, smisel, ki bo odvisen od pisem, ki jih sestavljajo, v kateri Količine se vzamejo in v katerem vrstnem redu. Lastnosti molekule proteinske molekule določajo sestavo aminokislin, število aminokislin povezav, kot tudi na vrstnem redu v verigi.
Zaporedje aminokislinskih ostankov v beljakovinski molekuli to določa primarno. Struktura (sl. 1-i). Če menimo, da je velikost ene aminokislinske ravni 0,35-0,37 nm, je očitno, da bi morala makromolekula beljakovin, ki je sestavljena iz stotine aminokislinskih ostankov, imeti več deset nanometrov. V resnici je velikost beljakovin precej manjša, saj je v prostoru polipeptidna veriga popolnoma ali delno zavita v vijak, ki je sekundarno Struktura beljakovin (sl. 1-II). Aminokislinske radikale ostanejo zunaj spirale zunaj in med NH skupinami, ki se nahajajo na enem mestu, in so-skupine, ki se nahajajo na sosednji zasuka spirala, vodikov vezi so oblikovane. So veliko šibkejši od kovalentnega, vendar ponavljajoče se večkrat daje trden oprijem. Polipeptidna spirala, "šivana" s številnimi vodikovimi vezi, je dovolj trdna struktura. Polipeptidna spirala je podvržena nadaljnjemu polaganju - zruši bizarno, vendar je za vsak beljakovin precej zagotovo in nenehno v tako imenovanem globusu (žoga), ki je terciary. Struktura molekule beljakovin (sl. 1-III).
Terciarna struktura beljakovin podpirajo vezi treh vrst: ionski, vodik in disulfid ter hidrofobne interakcije. V kvantitativnem smislu so hidrofobne odnose najpomembnejše: V vodnem mediju so celice hidrofobne radikale, odbijajo drug drugemu. Tako se zdi, da vodni medij prisili molekulo beljakovin, da vzame določeno naročeno strukturo, ki postane biološko aktivna.
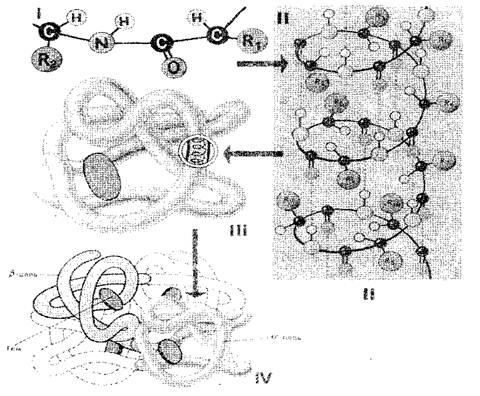
Sl. 1. Shema strukture beljakovinskih celic: I, II, III, IV - primarna, sekundarna, terciarna, kvarterna struktura
Beljakovine, sestavljene iz ene polipeptidne verige, imajo samo terciarno strukturo. Vendar pa so nekatere beljakovine zgrajene iz več polipeptidnih verig. Za njih so uvedli koncept kvaternarna struktura. (Sl. 1-iv), ki je ena funkcionalna enota, ki jo imajo hidrofobne interakcije in vodika in ionske vezi. Kvarterna struktura je značilna, na primer, za hemoglobin. Njegova molekula je sestavljena iz štirih ločenih polipeptidnih verig. Nekateri virusi, na primer, virus tobaka mozaika, ima beljakovinsko lupino, ki jo sestavljajo številne polipeptidne verige, ki so opremljene z zelo urejenim načinom.
V skladu z delovanjem različnih fizikalno-kemijskih dejavnikov (dejanja koncentriranih kislin in alkalijev, težkih kovin, visokih temperatur itd.) Struktura, zato se lahko razlikujejo lastnosti beljakovinskih molekul. Postopek kršitve naravne strukture beljakovin ali razkriva polipeptidne verige brez motenj peptidnih vezi denaturacija Beljakovin (sl. 2). Praviloma je denaturacija nepopravljiva, vendar je na prvih fazah, ob upoštevanju prekinitve delovanja negativnih dejavnikov, lahko beljakovin obnovijo svojo začetno strukturo - ta postopek se imenuje renatura. veverica. Postopek uničenja primarne beljakovinske strukture je vedno nepopravljiv, se imenuje uničenje beljakovin.
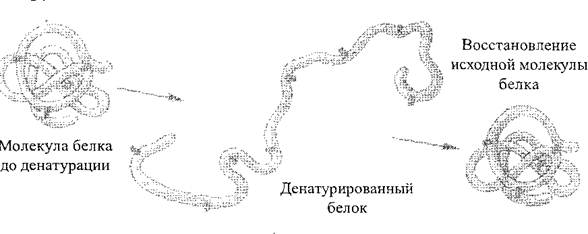
Sl. 2. Shema procesa denaturacije beljakovin
Fizikalne in kemijske lastnosti beljakovin so zelo raznolika: beljakovine so hidrofilne in hidrofobne, eden od njih pa zlahka spremeni svojo strukturo kot posledica manjših učinkov okoljskih dejavnikov, drugi pa so odporni na te dejavnike. V fizikalnih in kemijskih lastnostih so beljakovine razdeljene na preproste (beljakovine) in kompleksne (proteide).
Enostavne beljakovine so izključno iz aminokislinskih ostankov, spojine vključujejo tudi druge narave spojine, kot so preostale fosforne in nukleinske kisline, ogljikovi hidrati, lipidi itd.
Biološke funkcije beljakovin so izjemno raznolika. Najprej opravljajo gradnja Funkcija. Beljakovine so sestavni del celičnih membran, od katerih se takšni ne-emblemi celic celic, kot so mikrotubule in mikrons, komponente celičnega okostja (citoskeleton). Od beljakovin, ki imajo moč in elastičnost, je sestavljena iz hrustanca, kite, vezi. Iz trpežnih in netopnih proteinskih keratina, zgrajenih žebljev, perja. Poleg gradnje, se beljakovine izvajajo tudi zaščitna Funkcija, ki leži, je tako pri preprečevanju poškodb celic, organov in organizma kot celote in za zaščito telesa iz parazitov in tujih beljakovin. V telesu vretenčarjev se oblikujejo zaščitne beljakovine - protitelesa. To so specializirane beljakovine, ki jih proizvajajo krvni limfociti. Sposobni so »prepoznati« in nevtralizirati bakterije, viruse, tujce za telo beljakovin. Fibrin krvni beljakovin povzroči koagulacijo, ki ščiti telo iz velike izgube krvi.
Regulation. Funkcija beljakovin je sposobnost ureditve aktivnosti presnove z uporabo proteinskih naravnih hormonov, pa tudi beljakovinskih encimov. Beljakovine izvajajo I. signal. Funkcija. Sestoji iz sposobnosti posameznih kompleksnih beljakovin, ki so del celične membrane, "prepoznajo" specifične kemične spojine in se odzivajo na njih: da jih vežejo, spremenijo svojo strukturo, prenašajo signale o prisotnosti teh snovi na druga območja membrane ali znotraj celice. Zahvaljujoč funkciji signalov beljakovin lahko celica selektivno absorbirajo snovi iz zunanjega okolja.
Motor Funkcija beljakovin je v zmožnosti nekaterih od njih, da se skrčijo, s čimer zagotavljajo možnost celic, tkiv, telesa, kot celote, da spremeni svojo obliko, premik. Torej, zaradi takšnih beljakovin kot aktina in miozina, ki so del mišičnih celic, se mišična vlakna skrajša; Turbuslin beljakovin, iz katerega mikrotubule in mikro, zagotavlja gibanje cilije in okusov evkariontskih celic.
Nekatere beljakovine lahko preložimo s kletko o rezervi, s čimer se izvaja slika Funkcija.
V endosperma semen mnogih rastlinskih vrst (pšenica, koruza, riž) obstajajo beljakovine, ki jih Gerid hrani v prvih fazah njegovega razvoja. Funkcijo teh beljakovin je mogoče opredeliti kot hranljivo.
Beljakovine lahko vadijo transport. Nekaj \u200b\u200bsnovi v celici in v telesu. Na primer, beljakovine za človeške krvi in \u200b\u200bvretenčarji hemoglobin prevažajo kisik iz dihalnih organov na celice, in ogljikov dioksid - v nasprotni smeri.
Energija Funkcija beljakovin je, da se, ko se razdelijo v celici, energija sprosti. Nekatere aminokisline, ki se oblikujejo med delitvijo, se uporabljajo za biosintezo novih beljakovin, ostalo pa se razdeli na zadnje razpadajoče izdelke z izdajo energije (s polnim delitvijo 1 g beljakovin, 17,2 kJ energije se sprosti ).
Ena od glavnih funkcij beljakovin - encimski. Encimi so biološki katalizatorji ali kemijski reakcijski pospeševalniki, ki potekajo v živem organizmu. Kot je znano, je stopnja kemijskih reakcij bistveno odvisna od koncentracije snovi, kot tudi temperatura medija, v katerem te reakcije nadaljujejo. Če menimo, da je življenje celice (telo) kombinacija velikega števila reakcij sinteze in razpadanja, ki sestavljajo presnovo, veliko vlogo beljakovin-encimov v procesih preživetja telesa sploh ravni postanejo jasne. Samo zaradi encimov, pri relativno nizki temperaturi telesa in nizko koncentracijo snovi v celicah in tkivih, kemijske reakcije toka z dovolj visokimi hitrostjo (encimska reakcija tokovi 100-1000 krat hitreje kot v okolju brez encimov) . Katalizacijska aktivnost protein-encima ne povzroča celotne molekule, ampak le njegov majhen del, imenovan Active Center. Prostorska struktura aktivnega centra kot ključa do ključavnice je primerna v obliki prostorske strukture katalizirane snovi (substrat), ki pojasnjuje specifičnost protein-encimov (sl. 3).
Z denaturacijo beljakovinske molekule je struktura aktivnega centra pokvarjena, encim pa izgubi katalitsko sposobnost. Katalaza protein-encima, ki povzroči reakcijo delitve vodikovega peroksida (H 2 O 2) na kisik in voda izgubi katalitsko aktivnost po izpostavljenosti visokih temperaturah. Zato kapljica vodikovega peroksida, ki se uporablja za rezino surovega krompirja, ki vsebuje veliko količino katalaze, "vre", in na kuhanem krompirju - ostaja nespremenjena.
Beljakovine-encimi, Z povzročanjem prehoda kemijskih reakcij, sami ostanejo nespremenjeni, včasih se primerjajo z iglo, ki povezuje dva kosa tkanine skupaj, medtem ko ostane nespremenjena.
Encimi se nahajajo na določen način v celici in v telesu kot celoti. V kletki so encimi pogosto povezani s svojimi membranami ali membranami posameznih organelov (mitohondrija, plastika itd.). Učinek na telo drog, hormonov, strupov je, da lahko spodbujajo ali, nasprotno, injicirajo enega ali drugega encimskega procesa.
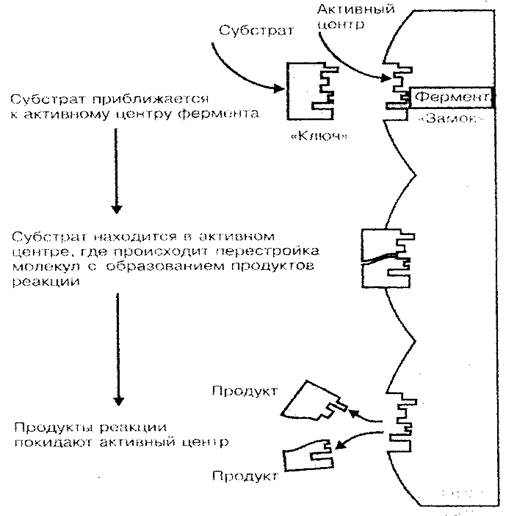
Sl. 3 Shema zavezujoče encim s substrat
Organizmi so sposobni prilagoditi biosintezo encimov. To omogoča ohranjanje relativne nesnosti njihove kemične sestave, ne glede na vedno spreminjajoče se okoljske razmere.
Laboratorijska številka 1
