Kemična sinteza DNK
Kemična sinteza DNK
Trenutno je mogoče precej hitro sintetizirati umetne fragmente nukleinskih kislin različnih dolžin in kakršne koli sestave (takšni fragmenti se imenujejo oligonukleotidi), nato pa jih s posebnimi encimi povežejo v daljše verige. Tako pridobljeni geni in njihovi fragmenti se pogosto uporabljajo v genskem inženiringu, biotehnologiji, pa tudi za diagnostiko nalezljivih in genetskih bolezni. Tako lahko uporabimo kemično sintetizirane oligonukleotide:
Za konstrukcijo celih genov ali njihovih fragmentov
Za pomnoževanje specifičnih fragmentov DNA
Za usmerjene mutacije izolirane DNK
Kot sonde za hibridizacijo
Kot povezovalci za lažje kloniranje.
Spomnimo se, da so nukleinske kisline nepravilni biopolimeri, sestavljeni iz monomernih struktur - nukleotidov (slika 29).
riž. 29. Sestava in struktura nukleotida.
Torej:
Nukleotid \u003d nukleozid + fosforna kislina \u003d dušikova baza + pentoza + fosforna kislina.
V RNA je pentoza riboza. DNK vsebuje deoksiribozo.
Sestava nukleinskih kislin in oligonukleotidov vključuje pet nukleotidov, ki se med seboj razlikujejo po strukturi dušikovega heterocikla. Trije od njih - derivati adenina (A), gvanina (G) in citozina (C) so vključeni tako v DNK kot v RNK, timin (T) - samo v DNK, uracil (U) - samo v RNK. Nukleotidi za razliko od nukleozidov vsebujejo ostanek fosforne kisline. Nukleotidi so med seboj povezani v polimerno verigo s fosfodiestrskimi vezmi (slika 30). Dušikove baze ne sodelujejo pri povezovanju nukleotidov ene verige.
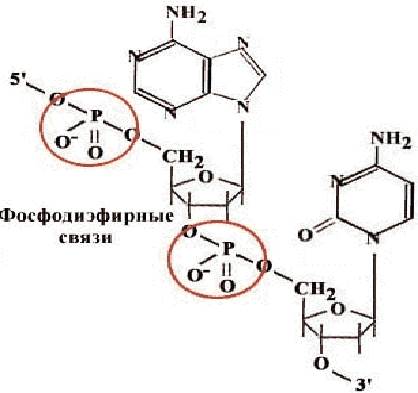
riž. 30. Shema povezovanja nukleotidov s fosfodiestrsko vezjo
Naloga kemijske sinteze nukleinskih kislin je kombinacija njihovih sestavnih monomerov v strogo določenem zaporedju. Za nastanek mednukleotidne vezi morata biti dva nukleotida povezana z izločanjem molekule vode. Nastali dimer nato reagira z naslednjim monomerom (nukleotidom) in tvori trimer itd. Za potek teh reakcij morajo biti izpolnjeni naslednji pogoji.
1. Treba je doseči selektivnost povezave monomernih enot. Na primer, hidroksilna skupina prvega nukleotida bi morala interagirati s fosfatnim ostankom drugega, ne pa obratno, ker eden od principov gradnje polinukleotidov v naravi je unipolarnost, tj. monomerna spojina vedno v smeri 5" → 3" . Za to je treba fragmente, ki ne sodelujejo v reakciji, blokirati s posebnimi zaščitnimi skupinami.
2. Hidroksilne in fosfatne skupine v nukleotidih same po sebi ne reagirajo med seboj. Za izvedbo kondenzacije monomerov je potrebno aktivirati fosfatno skupino.
3. Ker se sinteza izvaja v več fazah, mora vsaka reakcija potekati z zelo visokim izkoristkom.
4. Vsi postopki - vnos in odstranitev zaščitnih skupin, aktivacija in kondenzacija - morajo potekati v blagih pogojih, to je brez uporabe visokih temperatur, pa tudi koncentriranih raztopin kislin ali alkalij, ki bi lahko povzročile nastajanje stranskih produktov ter uničenje obstoječih in novonastalih kemičnih vezi.
Trenutno je bilo razvitih veliko število metod za sintezo oligonukleotidov, ki izpolnjujejo te pogoje, izbrane so bile primerne zaščitne skupine in predlagane metode za aktiviranje fosfatne skupine.
Sinteza razširjenih fragmentov nukleinskih kislin je sestavljena iz velikega števila stopenj. Po izvedbi vsake kemijske reakcije je potrebno izolirati nastali produkt, ga očistiti iz nezreagiranih izhodnih snovi in drugih nečistoč. Zaradi tega je postopek dolg in težaven, vodi pa tudi do znatnih izgub na vsaki stopnji izolacije.
Ameriški znanstvenik Robert Merrifield je leta 1962 predlagal izvirno idejo o metodi sinteze trdne faze, ki je omogočila drastično poenostavitev in pospešitev procesa. Ideja je, da je prvi monomer (nukleozid) vezan na netopen polimerni nosilec (trdna faza), ki je postavljen v reaktorsko kolono. Raztopino, ki vsebuje drugi monomer in druge potrebne reagente, spustimo skozi kolono. V tem primeru se izkaže, da je nastali reakcijski produkt vezan na trdno fazo. Kolono nato speremo s topilom, da odstranimo nereagirane snovi in stranske produkte, nato pa skozi reaktor spustimo naslednji monomer, pri čemer postopek večkrat ponovimo, dokler sinteza želenega produkta ni končana. Tako je rastoča polimerna veriga med sintezo fiksirana na trdni fazi, vse reakcije z drugimi komponentami v raztopini pa potekajo na nosilni površini. Ta tehnika omogoča zamenjavo zapletenih in dolgotrajnih postopkov ločevanja in čiščenja vmesnih produktov z osnovnimi operacijami pranja polimerov.
Sinteza vključuje več osnovnih faz.
Faza 1. Pridobivanje zaščitenih monomerov, ki so izhodiščni bloki za izgradnjo oligonukleotidne verige. Da bi to naredili, so tisti fragmenti molekul, ki ne bi smeli biti podvrženi kemičnim transformacijam, blokirani s posebnimi zaščitnimi skupinami.
Korak 2: Pritrditev končnega monomera (zaščitenega nukleozida) na polimerni nosilec. Nosilne granule s pritrjenim končnim monomerom se vnesejo v reaktorsko kolono.
Korak 3: Odstranitev zaščite končnega monomera. Da bi to naredili, raztopino reagenta spustimo skozi kolono, kar povzroči eliminacijo zaščitne skupine.
Faza 4. Kondenzacija, za katero skozi kolono prehaja raztopina drugega monomera, pomešana z aktivacijskim reagentom.
Koraka 3 in 4 se večkrat ponovita, dokler ne dobimo biopolimera zahtevane dolžine. Nato se izvedeta koraka 5 in 6.
Stopnja 5. Obdelava nosilca z reagenti, ki vodi do cepitve sintetiziranega produkta iz trdne faze in odstranitve vseh zaščitnih skupin.
Faza 6. Izolacija in čiščenje sintetiziranega fragmenta nukleinske kisline z uporabo različnih kromatografskih in elektroforetskih metod. (Zaradi nedokončanosti reakcij se proti koncu sinteze na nosilcu naberejo krajši delci verige, zato je potrebno temeljito čiščenje končnega produkta).
Glavni prispevek k razvoju sinteze oligonukleotidov je prispeval G. Korana, ki je v zgodnjih 60-ih izvedel kemično sintezo fragmentov nukleinske kisline določenega zaporedja in za to delo leta 1968 prejel Nobelovo nagrado. Leta 1970 je prvi sintetiziral popoln gen za prenos alanina RNA.
Leta 1975 je R. Letsinger predlagal novo metodo za tvorbo internukleotidne vezi, na podlagi katere je v zgodnjih 80-ih letih M. Carruthers razvil tako imenovano trdno fazno amidofosfitno ali fosforamiditno metodo za sintezo oligonukleotidov. Od takrat se je začel hiter razvoj te metode in njena avtomatizacija.
Začetni gradniki za sintezo oligonukleotida so modificirani deoksiribonukleozidi (amidofosfiti ali fosforamiditi). Te spojine, ki vsebujejo trivalentni fosfor, so bolj aktivne kot derivati peterovalentnega fosforja (slika 31).
Amidofosfitni monomeri so pridobljeni iz zaščitenih nukleozidov. Modifikacija je sestavljena iz vezave benzenske skupine na amino skupine deoksiadenozina in deoksicidina ter izobutiralne skupine na amino skupino deoksigvanozina. Timidin, ki nima amino skupine, ni spremenjen. Ta sprememba je potrebna za zaščito nukleozidov pred neželenimi stranskimi učinki.
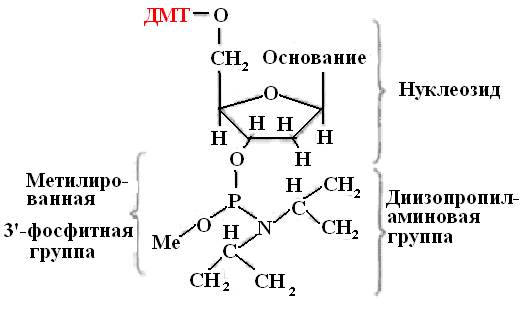
riž. 31. Strukturna formula fosforamidita
Takšni derivati vseh štirih baz - A, T, G in C se uporabljajo za kemijsko sintezo DNK.
DMT - dimetoksitritil
Me - metilna skupina
Sinteza se izvaja v trdni fazi, rastoča veriga DNA je fiksirana na trdnem nosilcu, kar omogoča izvajanje vseh reakcij v eni posodi, enostavno izpiranje nepotrebnih reagentov po vsaki stopnji in dodajanje novih v optimalni količini. popolna reakcija. Prvi nukleozid je fiksiran na trdno podlago s kemikalijo distančnik(Slika 32). To so običajno porozne steklene kroglice z enako velikimi porami.
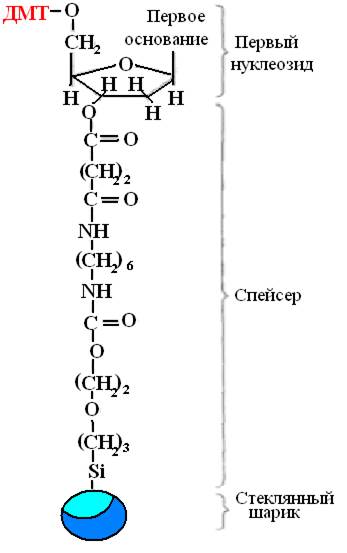
riž. 32. Prvi nukleozid, fiksiran z distančnikom.
Po n ciklih, izvedenih po shemi sinteze (slika 33), se iz n + 1 nukleotida tvori enoverižni fragment DNA.
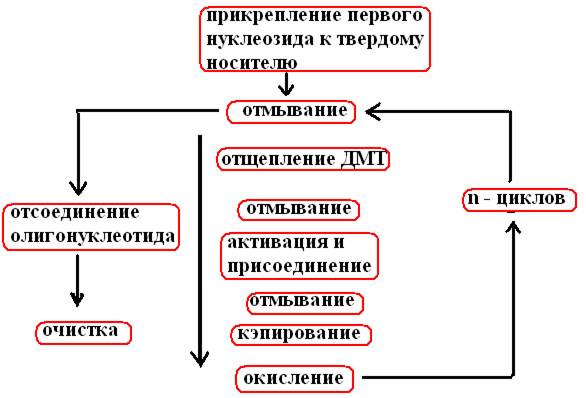
riž. 33. Shema kemijske sinteze oligonukleotida
Cikel se začne po pritrditvi prvega nukleozida na stekleno kroglico
Sprano z brezvodnim topilom (acetonitril), katerega ostanke odstranimo s splakovanjem z argonom.
Sprano s TCA (trikloroocetno kislino) za odstranitev DMT (detritilacija)
Ponovno se spere s topilom in TCA, prepihuje z argonom in na tej stopnji uvede naslednji nukleozid v obliki fosforimidita in tetrazola, ki aktivira fosforamidit, nevezane reagente odstranimo s prepihovanjem z argonom.
Ker na koncu prvega koraka niso vsi podprti nukleozidi vezani na fosforamidit, je treba preprečiti njihovo interakcijo z nukleozidom, dodanim v drugem koraku. Da bi to naredili, se nezreagirana 5'-OH skupina acetilira z anhidridom ocetne kisline in dimetilaminopiridinom (zapiranje).
Nestabilna fosfitna triestrska vez, ki nastane v drugi stopnji med nukleotidi, se oksidira z mešanico joda v petovalentni fosfatni triester.
Vse opisane operacije se izvajajo do zadnjega nukleozida, ki je dodan v rastno verigo v skladu s programom.
Metilne skupine se odstranijo s kemično obdelavo neposredno v reakcijski koloni. Nato se oligonukleotidi ločijo od distančne molekule skupaj s 3'-OH koncem in eluirajo iz kolone; nato se zaporedno odstranijo benzoilne, izobutiralne in DMT skupine. 5'-konec verige je fosforiliran z encimsko (polinukleotidna kinaza + ATP) ali kemično metodo.
Pomembna prednost metode trdne faze sinteze je preprostost operacij. Postopek sinteze je sestavljen iz ponavljajočih se korakov prehajanja zaščitenih monomerov, reagentov in topil skozi kolono s polimernim nosilcem, na katerega je pritrjena rastoča veriga. To omogoča avtomatizacijo postopka.
Avtomatski sintetizatorji vključujejo reaktor, ki vsebuje nosilec s prvim monomerom, pritrjenim nanj, in posode s potrebnimi monomeri, reagenti in topili. S pomočjo črpalke se raztopine iz teh posod izmenično dovajajo v reaktor v skladu z razpoložljivim programom in danim zaporedjem proteina ali fragmenta nukleinske kisline, ki se sintetizira. Trenutno avtomatske sintetizatorje peptidov in oligonukleotidov proizvajajo različna podjetja, vključno z domačimi.
Sekvenciranje DNK
Celovito informacijo o molekuli DNK lahko dobimo le z določitvijo njenega nukleotidnega zaporedja. Ta postopek se imenuje zaporedje(iz angleščine. zaporedje). Tako s sekvenciranjem gena, tj. po ugotovitvi nukleotidnega zaporedja določenega odseka DNA je pogosto mogoče ugotoviti njegovo funkcijo s primerjavo tega nukleotidnega zaporedja s tistimi za gene, katerih funkcija je že znana. Brez podatkov o nukleotidnem zaporedju je nemogoče izvajati raziskave molekularnega kloniranja, kot tudi ustvarjanje ekspresijske rekombinantne DNA.
Sekvenciranje DNK je precej drago. Zahtevajo posebno natančno opremo, ultra čiste kemikalije in biološke pripravke ter visoko usposobljene strokovnjake. Potencial biotehnologije bo v celoti izkoriščen šele, ko bodo njena orodja (vključno s sekvenciranjem genoma) postala tako dostopna in poceni kot osebni računalniki. Da bi zmanjšali stroške postopka sekvenciranja, razvijalci novih metod poskušajo zmanjšati število pripravljalnih korakov, miniaturizirati opremo do meje in sekvencirati na milijone molekul hkrati.
Preden nadaljujemo z opisom metod sekvenciranja, se je treba spomniti glavnih točk reprodukcije nukleotidnih zaporedij DNA, tj. nekateri temeljni koraki replikacije DNK.
DNK celice, ki se začne deliti, je podvržena kardinalnim spremembam: dvojna vijačnica se odvija, verige se razhajajo. Na vsaki verigi se začne sinteza komplementarnih polinukleotidov, na eni - neprekinjeno, na drugi - prekinjeno. Katalizira ga encim, imenovan DNA-odvisna DNA-polimeraza; drugi encim, DNA ligaza, povezuje polinukleotidne fragmente v neprekinjeno verigo. Torej iz ene molekule DNK nastaneta dve.
Številne metode sekvenciranja DNK temeljijo na medsebojni komplementarnosti verig te molekule. Genetska abeceda je sestavljena le iz štirih črk – dušikovih baz adenina (A), citozina (C), gvanina (G) in timina (T). Baze nasprotnih verig molekule DNA so povezane v skladu s pravilom komplementarnosti: A tvori par s T, C pa z G. Kot rezultat te interakcije nastane dobro znana dvojna vijačnica - a struktura, ki spominja na spiralno stopnišče (slika 34).
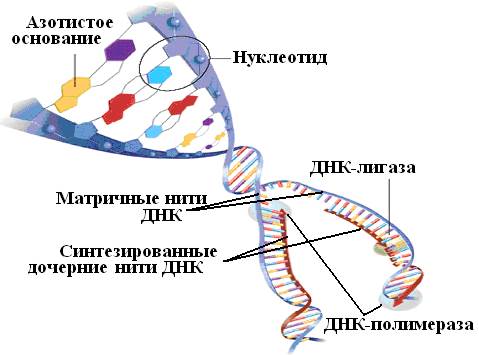
riž. 34. Shema za sintezo hčerinskih nukleotidnih verig na obeh verigah DNA
Živi organizmi uporabljajo načelo komplementarnosti za kopiranje svojega genskega materiala (replikacija) in popravljanje poškodb na njem (popravilo). Prav tako je podlaga za pomnoževanje (glej PCR) ciljnih fragmentov DNA in njihovo kasnejše sekvenciranje z uporabo metode, razvite v poznih sedemdesetih letih prejšnjega stoletja. F. Sanger.
