Proteinler: Bina ve özellikleri. Protekov fonksiyonları
Kompleks biyopolimerler arasında fonksiyonel değerde ve kantitatif oranda, ana rol proteinlere aittir. Hayvan hücresinde, kuru kütlesinin% 40-50'sini sebzeli - 20-30-35'dir. Çok çeşitli canlı varlıklar, proteinlerdeki farklılıklar ile büyük ölçüde belirlenir. Sadece insan vücudunda 5 milyondan fazla tip var. Böyle çeşitli proteinlerin nedeni, yapılarının özellikleri ile açıklanmaktadır. Proteinler temsil etmek polimerler, Monomerler hangileri amino asitler. Protein moleküllerinin bir parçası olan 20 tip amino asit, organizmalarda da mevcut olan diğer amino asitlerden ayrılmak, ancak protein moleküllerinin bir parçası olmamak için temel olarak adlandırılır. Moleküllerinin bileşimindeki tüm bu amino asitler aynı atom yapısına sahiptir.
N-oğlu, Coxy'nin bir karboksil grubu olduğu, bir NH2 -
amino grubu.
Dördüncü değerli karbon bağ, radikal (R) olarak adlandırılır. Çeşitli amino asit türlerinin radikalleri, kimyasal yapı, elektrik yükleri, ayrıca suda çözünme kabiliyetine göre birbirinden farklıdır. Amino asitler amfoterik bileşiklerdir, yani aynı amino asit bir asit ve alkali rolü olarak hareket edebilir. Asit özellikleri, karboksil grubunu (Coxy) ve alkalin - amino grubunu (NH2) verir. Amfaratity sayesinde amino asitler birbirleriyle etkileşime girebilir ve bunlardan biri asit olarak davranır ve diğeri alkali rolünde; Bir amino asidin bir karboksil grubu, başka bir amino grubu ile etkileşime girer). Protein böbreğinde amino asitlerin bileşiği, dayanıklı kovalent bağların pahasına gerçekleştirilir. Bu işlem böyle bir denklem kullanılarak yazılabilir:
Elde edilen amino asitlerin bileşiği peptid denir ve aralarında bir kovalent bağa - peptit bağıdır. Tüm proteinler polipeptitlerdir, yani birçok düzinelerce ve hatta yüzlerce amino asit bağlantısından oluşan zincirlerdir. 20 tip amino asit türünden, çok sayıda protein oluşturabilirsiniz, tıpkı alfabenin 20 harfinden olduğu gibi, anlamı, hangi harflerin yapıldıkları harflere bağlı olacak şekilde birçok kelime yapılabilir. Miktarlar alınır ve hangi sırada kurulur. Protein molekülünün özellikleri, amino asitlerin bileşimi, amino asit bağlantısı sayısının yanı sıra zincirdeki izlerinin sırası ile belirlenir.
Protein molekülündeki amino asit kalıntılarının sırası onu belirler birincil Yapı (Şekil 1-I). Bir amino asit seviyesinin boyutunun 0.35-0.37 nm olduğunu düşünürsek, yüzlerce amino asit kalıntısından oluşan protein makromolekülünün birkaç on rentiometreye sahip olması gerektiği açıktır. Gerçekte, proteinlerin büyüklüğü çok daha küçüktür, çünkü uzayda polipeptit zinciri tamamen veya kısmen sarmaldır. ikincil Protein yapısı (Şekil 1-II). Amino asit radikalleri, dışarıdaki spiral dışın dışında kalır ve bir turda bulunan NH grupları arasında ve spirallerin bitişik bükümünde bulunan eş gruplar arasında hidrojen bağları oluşturulur. Kovalentten çok daha zayıflar, ancak tekrar tekrar tekrarlanan katı bir kavrama verin. Çok sayıda hidrojen bağıyla "dikilmiş" olan polipeptit spiral, yeterince sağlam bir yapıdır. Polipeptit spirali daha fazla döşemeye tabi tutulur - tuhaf çömelmiştir, ancak her protein için kesinlikle ve sürekli olarak dünyadaki (top) üçüncülük Protein molekülünün yapısı (Şekil 1-III).
Üçüncül protein yapısı, üç türün bağları ile desteklenir: iyonik, hidrojen ve disülfür, ayrıca hidrofobik etkileşimler. Kantitatif terimlerle, hidrofobik ilişkiler en önemlidir: Sulu ortamda, hücreler hidrofobik radikallerdir, birbirlerine repeldir. Böylece, sulu ortam, bir protein molekülünü biyolojik olarak aktif hale gelen belirli bir düzenli yapıya girmeye zorluyor gibi görünüyor.
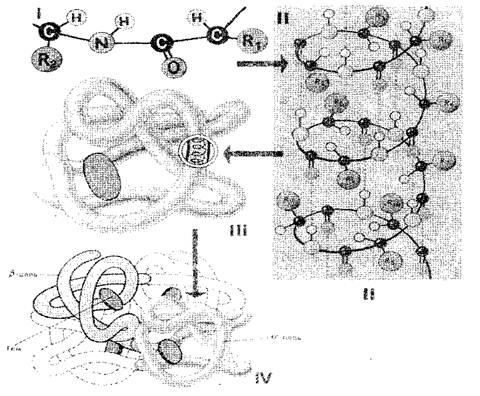
İncir. 1. Protein hücre yapısının şeması: I, II, III, IV - İlköğretim, İkincil, Tersiyer, Kuaterner Yapısı
Bir polipeptit zincirinden oluşan proteinler sadece üçüncül bir yapıya sahiptir. Bununla birlikte, bazı proteinler birkaç polipeptit zincirinden yapılmıştır. Onlar için kavramı tanıttı kuaterner yapı (Şekil 1-IV), hem hidrofobik etkileşim hem de hidrojen ve iyonik bağlar tarafından tutulan tek bir işlevsel bir ünitedir. Kuaterner yapısı, örneğin hemoglobin için karakteristiktir. Molekülü dört ayrı polipeptit zincirinden oluşur. Örneğin, tütün mozaik virüsünün bazı virüsleri, oldukça sıralanmış bir şekilde paketlenmiş birçok polipeptit zincirinden oluşan bir protein kabuğuna sahiptir.
Çeşitli fizikokimyasal faktörlerin etkisi altında (konsantre asitler ve alkaliler, ağır metaller, yüksek sıcaklıklar, vb.) Yapısı ve dolayısıyla protein moleküllerinin özellikleri değişebilir. Proteinin doğal yapısının ihlal edilmesi veya peptid bağlarının bozulması olmadan bir polipeptit zincirinin açılması denatürasyon Protein (Şekil 2). Bir kural olarak, denatürasyon geri dönüşü değildir, ancak, ilk aşamalarda, olumsuz faktörlerin etkisinin askıya alınması durumunda, protein ilk yapısını geri yükleyebilir - bu işlem denir renatura sincap. Birincil protein yapısının imha süreci her zaman geri dönüşümsüzdür, protein yıkımı denir.
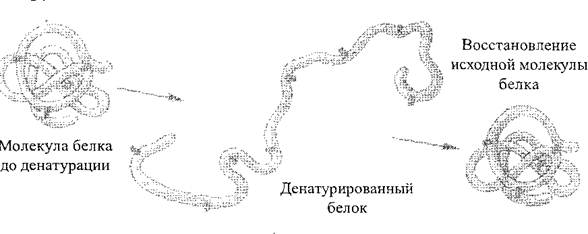
İncir. 2. Protein Denatürasyon Süreci Şeması
Proteinlerin fiziksel ve kimyasal özellikleri çok çeşitlidir: proteinler hidrofilik ve hidrofobiktir, bunlardan biri, çevresel faktörlerin küçük etkileri bile bir sonucu olarak yapılarını kolayca değiştirir, diğerleri bu faktörlere karşı dayanıklıdır. Fiziksel ve kimyasal özelliklerde, proteinler basit (proteinler) ve kompleks (proteidler) ayrılır.
Basit proteinler sadece amino asit kalıntılarından oluşur, bileşik ayrıca artık fosforik ve nükleik asitler, karbonhidratlar, lipitler vb. Gibi diğer doğa bileşiklerini içerir.
Proteinlerin biyolojik fonksiyonları son derece çeşitlidir. Her şeyden önce, performans sergiliyorlar İnşaat işlevi. Proteinler, mikrotübül ve mikronlar gibi hücre hücrelerinin hücrelerinin hücrelerinin bu tür amblemlerinin, hücre iskeletinin (sitoskeleton) bileşenlerinden oluşan hücrelerinin ayrılmaz bir parçasıdır. Güç ve elastikiyete sahip proteinlerden, kıkırdak, tendonlar, ligamanlardan oluşur. Dayanıklı ve çözünmeyen protein keratin inşa çivilerden, tüyler. İnşaat ek olarak, proteinler de gerçekleştirir koruyucu Yalan işlevi, hem hücrelere, organlara hem de organizmanın bir bütün olarak ve vücudun parazitlerden ve yabancı proteinlerden korunmasında hasar görmesinde. Omurgalı hayvanların gövdesinde, koruyucu proteinler oluşturulur - antikorlar. Bunlar, kan lenfositleri tarafından üretilen özel proteinlerdir. Bakterileri, virüsleri, uzaylıyı protein gövdesine "tanımak ve nötralize edebilirler. Fibrin kan proteini pıhtılaşmasına neden olur, vücudu büyük kan kaybından korur.
Düzenleyici Proteinlerin işlevi, protein doğa hormonlarını ve protein enzimlerini kullanarak metabolizmanın aktivitesini düzenleme yeteneğidir. Proteinler I. sinyal işlevi. Hücre zarının bir parçası olan bireysel karmaşık proteinlerin, "belirli kimyasal bileşikleri tanı ve bunlara tepki verir, bunları bağlamak, bunları bağlamak, bunları değiştirmek, bu maddelerin varlığıyla ilgili sinyalleri membranın diğer alanlarına iletir. veya hücrenin içinde. Proteinlerin sinyal işlevi sayesinde hücre, dış ortamdaki maddeleri seçici olarak emebilir.
Motor Proteinlerin işlevi, bazılarının küçülmesi, böylece hücrelerin, dokuların, gövdenin şeklini değiştirmesi için bir bütün olarak hücrelerin, dokuların, gövdenin bir bütün olarak sağlanmasını sağlar. Öyleyse, aktin ve mus hücrelerinin bir parçası olan miyosin gibi proteinler nedeniyle, kas elyafı kısaltılır; Mikrotübülün ve mikrodan gelen türbülin proteini, silianın ve ökaryotik hücrelerin lezzetlerinin hareketini sağlar.
Bazı proteinler rezerv hakkında bir kafesle ertelenebilir, böylece gerçekleştirilebilir. boyama işlevi.
Birçok bitki türünün tohumlarının endosperminde (buğday, mısır, pirinç), gelişiminin ilk aşamalarında beslenmelerinin proteinleri vardır. Bu proteinlerin işlevi olarak tanımlanabilir besleyici.
Proteinler egzersiz yapabiliyor ulaşım Hem hücrenin içindeki ve vücudun içindeki bazı maddeler. Örneğin, insan kan proteini ve omurgalı hayvanlar hemoglobin, solunum organlarından oksijenleri hücrelere ve karbondioksit - ters yönde taşır.
Enerji Proteinlerin işlevi, hücreye ayrıldıklarında, enerji serbest bırakılır. Bölme sırasında oluşan amino asitlerin bazıları, yeni proteinlerin biyosentezi için kullanılır ve geri kalanı, enerjinin salınması ile son çürüme ürünlerine bölünmüştür (tam bölünmüş 1 g protein, 17.2 KJ enerji serbest bırakılır. ).
Proteinin ana fonksiyonlarından biri - enzimatik. Enzimler, bir canlı organizmadan geçen biyolojik katalizörler veya kimyasal reaksiyon hızlandırıcılarıdır. Bilindiği gibi, kimyasal reaksiyon hızı, maddelerin konsantrasyonuna, yanı sıra bu reaksiyonların devam ettiği ortamın sıcaklığına önemli ölçüde bağlıdır. Hücrenin (gövde) ömrünün, metabolizmayı oluşturan çok sayıda sentez ve çürüme reaksiyonunun bir kombinasyonu olduğunu, vücudun geçim kaynaklarının süreçlerinde protein-enzimlerin büyük rolüdür. Seviyeler netleşir. Sadece enzimler nedeniyle, vücudun nispeten düşük bir sıcaklığında ve hücrelerinde ve dokulardaki düşük bir madde konsantrasyonundan, kimyasal reaksiyonlar yeterince yüksek bir hızla akış (enzimatik reaksiyon, enzimler olmayan bir ortamdan 100-1000 kat daha hızlı akar) . Protein-enzimin katalitik aktivitesi, tüm moleküle değil, ancak yalnızca küçük kısmı aktif merkez olarak adlandırılır. Aktif merkezin kilidin anahtarı olarak mekansal yapısı, protein-enzimlerin spesifikliğini açıklayan katalizli maddenin (substratın) uzamsal yapısına göre uygundur (Şekil 3).
Protein molekülünün denatürasyonu ile, aktif merkezin yapısı bozulur ve enzim katalitik yeteneğini kaybeder. Böylece, hidrojen peroksit (H202) bölünmesinin reaksiyonunun oksijene ve suya olan reaksiyona neden olan protein-enzim katalazı, yüksek sıcaklıklara maruz kaldıktan sonra katalitik aktivitesini kaybeder. Bu nedenle, bir damla hidrojen peroksit, büyük miktarda katalaz, "kaynar" ve haşlanmış patatesler içeren bir dilim ham patato için uygulanan bir damla, değişmeden kalır.
Proteinler-enzimler, Kimyasal reaksiyonların geçişine neden olarak, kendileri değişmeden kalırlar, bazen iki parçayı birbirine bağlayan bir iğneyle karşılaştırılırken, değişmeden kalırlar.
Enzimler, hücrede ve vücutta bir bütün olarak belirli bir şekilde bulunur. Bir kafeste, enzimler genellikle bireysel organellerin membranları veya membranları ile ilişkilidir (mitokondri, plastid vb.). İlaçların, hormonların, zehirlerin gövdesi üzerindeki etkisi, bir veya başka bir enzimatik işlemi enjekte etmek için aksine veya aksine uydurabilecekleridir.
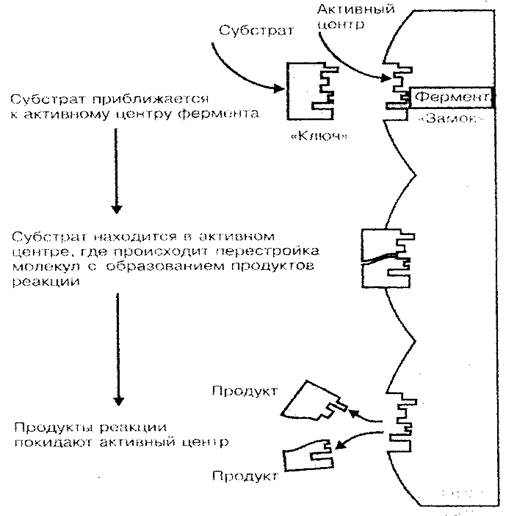
İncir. Substratlı 3 Enzim Bağlama Şeması
Organizmalar, enzimlerin biyosentezini ayarlayabilir. Bu, sürekli değişen çevresel koşullardan bağımsız olarak, kimyasal bileşimlerinin göreceli sabitliğini korumayı mümkün kılar.
Laboratuvar iş numarası 1
